
【题目】下列说法中正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.标准状况下,aL的氧气和氮气的混合物含有的分子数约为 ![]() ×6.02×1023
×6.02×1023
C.常温常压下,48g O3气体含有的氧原子数为6.02×1023
D.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
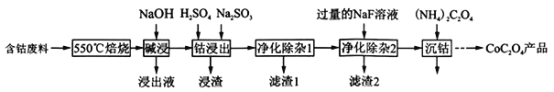
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是____________________ (用离子方程式表示);再升温至80~85℃,加入___________溶液,调pH至4.5以达到净化除杂的目的。
(5)“净化除杂2”过程中,若溶液c(Ca2+)=0.01mol/L,使Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时是否有CaF2沉淀生成________________?(列式计算)[已知Ksp(MgF2) =7.0×10-11、Ksp(CaF2) =1.0×10-10]。
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 ![]() 2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
A. 等于1.6 mol B. 等于1.2 mol
C. 小于1.2 mol D. 大于1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.简单离子的半径先减小后增大,卤素离子半径最大
b.元素金属性减弱,非金属性增强
c.最高价氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点逐渐降低
(2)原子最外层电子数是次外层电子数一半的元素名称为____,还原性最弱的简单阴离子是____。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 共价化合物 | |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是________________________________,根据熔点推测Al2O3是___________化合物。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____________,在上述由SiCl4(g)制纯硅的反应中,测得每生成0.56 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_____________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,但可用P2O5干燥的是_________。
a.HI b.NH3 c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用托盘天平称量镁粉25.2 g (1 g以下用游码),他把镁粉放在右盘,当天平平衡时,所称取的镁粉的实际质量是( )
A. 25.2 g B. 24.8 g C. 24.2 g D. 25.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和H2O六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1) A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: ________________________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在元素周期表中的位置是____________________。
(3)E能使湿润的红色石蕊试纸变蓝,E的结构式为__________________,工业制取E气体的化学方程式为___________________________。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为____________________、____________________、__________________。
(5)取一定量的X晶体分解,若生成0.1mol F,则必同时生成____________(填化学式)________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核糖是合成核酸的重要原料之一,其结构简式为CH2OH—CHOH—CHOH—CHOH—CHO,下列关于核糖说法正确的是
A.能发生还原反应
B.能发生水解反应
C.能与NaOH反应
D.与葡萄糖互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com