
已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A.a=b
B.混合溶液的PH值为7
C.混合溶液中,
D.混合溶液中,
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学试卷(解析版) 题型:实验题
甲、乙两同学欲分别完成“钠与氯气反应”的实验。

I.甲同学的方案为:取一块绿豆大的金属钠(除去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶抽去玻璃片后倒扣在钠的上方(装置如图工)。该方案的不足之处有 。
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 ;待整套装置中 后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是__________________。
(3)乙同学欲将虚框内装置改为图III,所示装置,并测量多余气体的体积。
①为提高测量的准确性,图III,量气管装置中的液体可用 ;收集完气体后并读数,读数前应进行的操作是冷却至室温并 。
②若未冷却至室温立即按上述操作读数,则会导致所观测气体的体积 (填“偏大”“偏小”或“无影响”,下同)。
③如果开始读数时操作正确,最后读数时俯视右边量气管液面,会导致所测气体的体积 。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.化学反应速率的大小主要由浓度、温度、压强等外界因素决定
B.化石燃料是不可再生能源,生物质能是可再生能源
C.许多水果与花卉的芳香气味是因含有酯的原因
D.人工合成尿素,彻底动摇了“生命力论”,使有机化学迅猛发展
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:选择题
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖。已知二羟甲戊酸是生物合成青蒿素的原料之 一,下列关于二羟甲戊酸的说法正确的是
一,下列关于二羟甲戊酸的说法正确的是
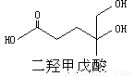
A.二羟甲戊酸的分子式为C6H10O4
B.在铜的催化下与氧气反应的产物能发生银镜反应
C.能发生加成反应,不能发生取代反应
D.1mol该有机物可以与足量金属钠反应产生33.6L H2
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
选修3——物质结构与性质]
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为_____________,其第一电离能比Z元素原子的第一电离能________(填“高”或“低”)
(2)X的氯化物的熔点比Q的氯化物的熔点_______________(填“高”或“低”),理由是___________________
(3)光谱证实元素W的单质与强碱性溶液反应有W(OH)4]-生成,则W(OH)4]-中存在_______(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_________;晶体中每个镁原子周围距离最近的R原子有___________个。
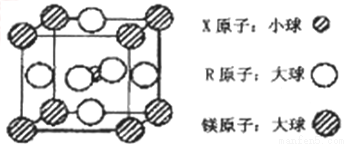
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列化学用语完全正确的一组是:
A.电子式:
B.KHSO4熔融电离:
KHCO3溶解于水:
C.高聚物化学式:聚异戊二烯: ;
;
PVC: ;PE:
;PE:
D.下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:填空题
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式 。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:选择题
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A.1︰1 B.2︰1 C.1︰2 D.2︰3
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com