
下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
|
元素代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(nm) |
0.186 |
0.160 |
0.152 |
0.143 |
0.110 |
0.099 |
0.075 |
0.074 |
|
主要化合价 |
+1 |
+2 |
+1 |
+3 |
+5、-3 |
+7、-1 |
+5、-3 |
-2 |
回答下列问题:
(1)⑥在元素周期表中的位置是(周期、族) 。
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。
(3)①⑥形成物质的电子式
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:
。
(5)下列叙述正确的是 (填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
(11分)(1)第三周期第VIIA族(2分) (2)HClO4 (2分)
(3)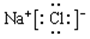 (2分) (4)Al(OH)3 + 3H+= Al3+ + 3H2O (2分) (5)A、B、D (3分)
(2分) (4)Al(OH)3 + 3H+= Al3+ + 3H2O (2分) (5)A、B、D (3分)
【解析】
试题分析:根据元素原子半径和主要化合价可知,①~⑧元素分别是Na、Mg、Li、Al、P、Cl、N、O。
(1)氯元素在元素周期表中的位置是第三周期第VIIA族。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,则在这8种元素的最高价氧化物的水化物中,酸性最强的是HClO4。
(3)①⑥形成物质是氯化钠,含有离子键的离子化合物,其电子式为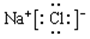 。
。
(4)④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式Al(OH)3 + 3H+= Al3+ + 3H2O。
(5)⑥在同主族元素中非金属性不是最强的,最强的是F,C不正确;①与⑧形成的化合物是氧化钠或过氧化钠,不具有两性,E不正确,其余选项都是正确的,答案选ABD。
考点:考查元素周期表的结构、元素周期律的应用
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com