
【题目】化学与生产生活息息相关。下列说法不正确的是
A.城市空气质量报告中,PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
B.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”能提高空气质量
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.氧化亚铁可以用作色素,如应用于瓷器制作中使釉呈绿色
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是

A. M的原子半径比N小
B. Y和Z既可形成Z2Y,也可形成Z2Y2
C. X2M的热稳定性比X2Y强
D. M和N的氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组经资料检索后发现,药物贝诺酯能可由乙酸水杨酸和对乙酰氨基酚在一定条件下反应制得,其反应的化学方程式为
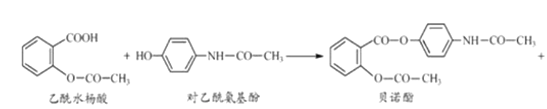 H2O
H2O
下列有关叙述错误的是( )
A.贝诺酯、乙酰水杨酸分子中都有酯基
B.对乙酰氨基酚的分子式为C8H9O2N
C.乙酰水杨酸能与NaHCO3溶液反应,并放出二氧化碳气体
D.贝诺酯与足量 NaOH 溶液共热,最终产物之一是乙酰水杨酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
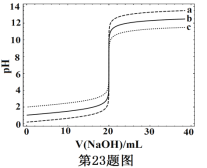
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:
实验1:准确称取Wg草酸晶体配成100ml水溶液;
实验2:用浓度为0.100molL-1KMnO4溶液滴定所配制的草酸溶液,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)实验1中,配制100ml草酸水溶液所需要的一组仪器是________(填相应编号)
A、0.001g的电子天平 B、50ml酸式滴定管 C、100ml量筒 D、100ml容量瓶 E、烧杯 F、胶头滴管 G、锥形瓶
(2)实验2中H2C2O4·xH2O中x值的测定是利用氧化还原反应滴定法
①其中正确操作步骤的顺序为___________
a.用移液管取用25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸。
b.把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c.取KMnO4标准液注入滴定管中至“0”刻度以上
d.调节液面至“0”或“0”刻度以下,记下读数
e.把标准KMnO4溶液润洗滴定管2~3次
f.把锥形瓶放在滴定管下面,用KMnO4标准液滴定至终点并记下滴定管的读数
②下列关于滴定分析,正确的是________________。
A. 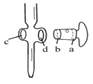 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
C. 将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D. 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E. 滴定到终点时俯视读取数据,测得的x值偏大
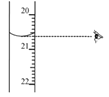
③图中滴定终点时显示的读数为_______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
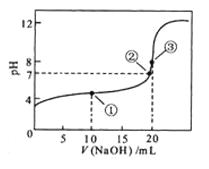
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(C3H3N)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下。
①C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1
请回答下列各题:
(1)关于上述反应,下列说法正确的是____。
A.增大压强有利于提高丙烯腈平衡产率
B.反应②的ΔS等于零
C.可以选择合适的催化剂来提高混合气中丙烯腈的生产效率
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则说明两反应均达到平衡状态
(2)一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,该温度下反应②的平衡常数为____。
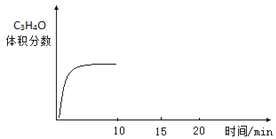
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,15min重新达到平衡,请在图中画出10min~20min内C3H4O的百分含量的变化图__________。
(4)如图为一定时间内丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。下列说法正确的是_____。

A.460℃之前产率随温度升高而增大是因为随温度升高反应平衡常数变大
B.高于460℃产率下降的原因可能是温度升高催化剂活性降低
C.460℃时C3H6的转化率一定大于500℃
D.温度过高副反应可能变多不利于合成丙烯腈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置 | 实验编 号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
| ① | H2O | 7 |
|
② | 1.0 mol·L-1 NH4Cl | 5 | ||
③ | 0.5 mol·L-1 (NH4)2SO4 | 5 | ||
④ | 1.0 mol·L-1 NaCl | 7 | ||
⑤ | 0.5 mol·L-1Na2SO4 | 7 |
下列说法不正确的是
A.①与④⑤比较说明盐溶液可以加快吸氧腐蚀速率
B.向实验②溶液中加等体积的 0.5 mol·L-1 (NH4)2SO4,吸氧腐蚀速率一定加快
C.②与③、④与⑤比较说明吸氧腐蚀速率可能与阴离子种类有关
D.向实验⑤溶液中加入少量(NH4)2SO4 固体,吸氧腐蚀速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com