
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。 它易溶于水,不溶于乙醇,具有较强的还原性, 可应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O 属于________(填“纯净物”或“混合物”)。
(2)酸性条件下, S2O32-自身发生氧化还原反应生成 SO2。试写出 Na2S2O3 与盐酸反应的离子方程式:_________________________________________。
(3)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为_________________________________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2S2O3、 Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________ (填试剂名称),若___________________________(填现象),则证明产品中含有Na2SO3和 Na2SO4(已知: Na2S2O3 稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定称取 6 g 粗品配制 250 mL 的溶液待用。另取 25.00 mL 0.0100 mol· L-1 K2Cr2O7 溶液于锥形瓶中,然后加入过量酸化的 KI 溶液并酸化和几滴淀粉溶液,立即用配制的 Na2S2O3溶液滴定至终点,消耗 Na2S2O3 溶液 25.00 mL。 滴定终点的现象是________。粗品中Na2S2O3·5H2O的质量分数为__________。已知 Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、 I2+2S2O32- =2I-+S4O62-。
【答案】 纯净物 S2O32-+2H+=S↓+SO2↑+H2O Na2SO3+S![]() Na2S2O3 稀盐酸 沉淀未完全溶解(并有刺激性气味气体生成) 溶液蓝色逐渐褪去,并在半分钟内不再变蓝 62.0%
Na2S2O3 稀盐酸 沉淀未完全溶解(并有刺激性气味气体生成) 溶液蓝色逐渐褪去,并在半分钟内不再变蓝 62.0%
【解析】(1)Na2S2O3·5H2O是固定组成的物质,所以属于纯净物;
(2)酸性条件下,S2O32-自身发生氧化还原反应生成SO2,根据氧化还原反应规律,它与盐酸反应的离子方程式为S2O32-+2H+=S↓+SO2↑+H2O;
(3)①由转化关系图可知,由Na2SO3和硫粉反应后,经过一系列物理过程生成Na2S2O3·5H2O,因此反应的化学方程式为Na2SO3+S![]() Na2S2O3;
Na2S2O3;
②根据已知信息,粗产品中加入氯化钡溶液,产生白色沉淀为BaSO3和BaSO4,所以向沉淀中应加入稀盐酸,若沉淀部分溶解,并有刺激性气味气体生成,即可证明产品中含有 Na2SO3和 Na2SO4;
③已知淀粉遇碘单质显蓝色,根据反应过程可知,加入的KI被K2Cr2O7氧化为I2,然后I2与Na2S2O3反应又转化为I-,因此滴加Na2S2O3溶液至终点时的现象为溶液蓝色褪去,并在半分钟内不再显蓝色;根据反应方程式可得Cr2O72- ~~~6S2O32- ,已知n(Cr2O72- )=2.5×10-2 L ×0.0100 mol· L-1=2.50×10-4 mol ,则n(S2O32-)=2.5×10-4 mol×6×10= 1.5×10-2 mol,Na2S2O3·5H2O的质量分数为![]() ×100%=62.0%
×100%=62.0%


科目:高中化学 来源: 题型:
【题目】Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
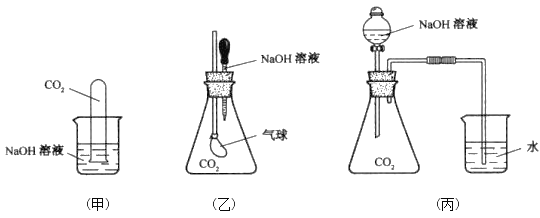
(1)请写出甲实验中CO2与过量的NaOH发生反应的离子方程式:__________。
(2)丙实验装置的实验现象是________________________。
(3)乙实验中,如果二氧化碳和氢氧化物的物质的量之比为1:1.5,且恰好完全反应,溶液中含有的溶质主要是_______________。
A、NaOH 和Na2CO3 B、Na2CO3 C、Na2CO3和NaHCO3 D、NaHCO3
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图:
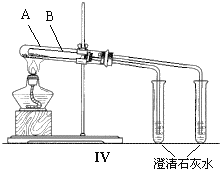
(1)小试管B中应装的药品是________(写化学式)。
(2)和大试管A相连的装有澄清石灰水的小试管中出现的现象预计是____________________。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)称取质量为m1 g的样品溶解后加入过量的CaCl2溶液,将所得沉淀______________(填操作)、洗涤、烘干、称量得到m2 g固体,则Na2CO3的质量分数是_____________________。
方案二:气体分析法
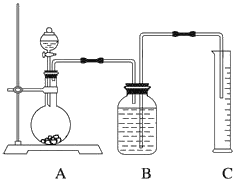
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,实验结束后,量筒中得到V mL液体,则反应中生成二氧化碳的物质的量是____________(题目中气体体积均已经换算成标准状况),为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠,因为二氧化碳难溶于饱和碳酸氢钠,但选用该溶液后实验结果仍然不够准确,Na2CO3的质量分数偏大,其原因可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)①Fe原子的核外电子排布式为[Ar]_________,Mg原子核外占据最高能层电子的电子云轮廓图形状为_________。
②As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为

以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间作用力有________。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2 LCH2Cl2中含有分子的数目为0.5NA
B. 常温下a g某烷烃(CnH2n+2)中含有共用电子对数目为![]() (3n+1)NA
(3n+1)NA
C. 56 g 聚乙烯中含有碳碳双键的数目为2NA
D. 常温下,0.2 mol/L的FeCl3溶液中含Cl﹣数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器中充入SO2和只由18O原子组成的氧气(18O2)。在一定条件下达到平衡时,18O存在于
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.SO3、SO2和O2中都有可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种
B. 联苯(![]() )的一氯代物有3种,二氯代物有12种
)的一氯代物有3种,二氯代物有12种
C. 丙烷的一氯代物有2 种,丙烷的二氯代物有4 种
D. 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中一定不存在的金属离子是( )
A.Fe2+和Cu2+
B.Fe3+
C.Cu2+
D.Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com