
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
 HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:不详 题型:单选题
 Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
B.对2HI H2+I2平衡体系增加压强使颜色变深 H2+I2平衡体系增加压强使颜色变深 |
| C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g)
2C(g) 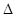 H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( ) 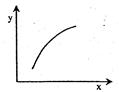
| 选项 | x | y |
| A | 降温 | A的体积分数 |
| B | 升高温度 | 混合气体的密度 |
| C | 再加入A | B的转化率 |
| D | 再加入C | A的体积分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com