
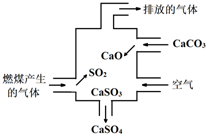
| A. | 使用此装置可减少导致酸雨的气体形成 | |
| B. | 用酸性高锰酸钾溶液检验废气处理是否达标 | |
| C. | 整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 | |
| D. | 排放的气体是纯净物 |
分析 A、二氧化硫是形成酸雨的重要物质;
B、酸性高锰酸钾溶液褪色说明气体不达标;
C、根据反应过程可以书写反应的化学方程式;
D、根据图示中的信息判断.
解答 解:A、二氧化硫是形成酸雨的重要物质,经过处理后能减少酸雨的形成.故A正确;
B、二氧化硫能使酸性高锰酸钾溶液褪色,所以可用酸性高锰酸钾溶液检验废气处理是否达标,故B正确;
C、整个过程中,二氧化硫与碳酸钙和氧气反应生成了硫酸钙和二氧化碳,化学反应式可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2,故C正确;
D、根据图示信息可知,进入烟囱的是洁净的气体,洁净并不代表是纯净物,故D错误;
故选D.
点评 本题考查废气的处理,解答本题要充分理解处理废气的过程,只有这样才能对相关方面的问题做出正确的判断.


科目:高中化学 来源: 题型:选择题
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入HCl气体 | D. | 向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
| 0 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | HF、HClO、NH3都易溶于水,都是电解质 | |
| D. | C2H2、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com