
【题目】Ⅰ.甲、乙、丙三种物质有如图所示的转化关系。

若甲、乙、丙依次是氢气、水、硫酸。
(1)写出甲―→乙的化学方程式:_____。
(2)乙―→丙时所需另一种反应物中,一定含有____和氧元素。
若甲为碳酸钙,丙为氯化钙。
(3)乙可以是______(填名称)。
Ⅱ.N原子的摩尔质量是_____;1molHNO3的质量是____;标准状况下11.2LHCl气体的物质的量是___;2molOH-约含有___个电子。
【答案】2H2+O2![]() 2H2O 硫元素 氧化钙(或碳酸氢钙) 14g/mol 63g 0.5mol 1.204×1025
2H2O 硫元素 氧化钙(或碳酸氢钙) 14g/mol 63g 0.5mol 1.204×1025
【解析】
I.(1)甲是氢气,乙是水,氢气生成水,可以用燃烧法,也可以用氢气还原氧化铜;
(2)乙是水,丙是硫酸,可想到三氧化硫与水直接化合;
(3)甲为碳酸钙、丙为氯化钙,可想到碳酸钙的分解反应产生氧化钙,氧化钙与盐酸反应生成氯化钙;可以想到先将碳酸钙转化为碳酸氢钙,然后再与盐酸反应,可生成氯化钙;
II利用![]() 进行求解。
进行求解。
I.(1)甲是氢气,乙是水,可想到氢气与氧气或含氧元素的物质反应。甲生成乙的化学方程式为:2H2+O2![]() 2H2O或H2+CuO
2H2O或H2+CuO![]() Cu+H2O等;
Cu+H2O等;
(2)乙是水,丙是硫酸,据元素守恒可知,另一种反应物中肯定有硫元素,可想到三氧化硫与水直接化合:SO3+H2O=H2SO4;
(3)若甲为碳酸钙、丙为氯化钙,则想到乙与盐酸反应生成氯化钙,能与盐酸反应生成氯化钙的,想到乙可能为氧化钙、碳酸氢钙等,可以分别通过碳酸钙分解或化合制得:CaCO3![]() CaO+CO2↑、CaCO3+CO2+H2O=Ca(HCO3)2;
CaO+CO2↑、CaCO3+CO2+H2O=Ca(HCO3)2;
II.氮原子的摩尔质量是14g·mol-1,其数值与氮原子的相对原子质量相等;
HNO3的摩尔质量是63g/mol,所以1molHNO3的质量是63g;
标准状况下11.2LHCl气体的物质的量是:![]() =0.5mol;
=0.5mol;
每个OH-含有10个电子,则2molOH-含有20mol电子,其个数为:6.02×1023/mol×20mol=1.204×1025个。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: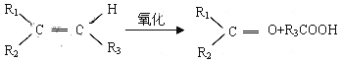
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的CO2和O2,其分子数目之比为_____,原子数目之比为___,氧原子数目之比为____;质量相同的CO2和O2,其物质的量之比为____。
(2)4.8gO2和0.2 mol CO2,它们的物质的量之比是____,质量之比是____,在同温同压下的体积之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 4.6gC2H5OH与6.0gCH3COOH反应,生成的 CH3COOC2H3分子数目为0.1NA
B. 5.6gFe与足量水蒸气完全反应,转移的电子数目为0.2NA
C. 32gO2和O3的混合物中含有的氧原子数目为2NA
D. 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在工业上应用广泛,硫化物是脱硫、染料行业重要的原村料。
(1)酸工业烟道气中的SO2、CO.可用如图所示的综合循环吸收法脱除:

已知再生塔中每产生 I mol CO2(g),放出29.9的热量,则其热化学方程式为______。
(2)H2S热分解反应为:2H2S(g)![]() 2H2(g)+S2(g)。在恒容密闭容器中,H2S的起始浓度均为cmolL—1,控制不同温度使之分解.相同时间后测的H2S转化率曲线如图1所示:其中a为平衡时转化率、b为未平衡时转化率分别与温度的关系曲线。
2H2(g)+S2(g)。在恒容密闭容器中,H2S的起始浓度均为cmolL—1,控制不同温度使之分解.相同时间后测的H2S转化率曲线如图1所示:其中a为平衡时转化率、b为未平衡时转化率分别与温度的关系曲线。
①在975℃:t秒时反应达到平衡,则平衡前反应的平均速率v(S2)=_____(用含c、t的代数式表示)。
②请说明随温度的升高,曲线b向曲线a逼近的原因:______________。

(3)725℃时,H2S的电离平衡常数K=1.3×10-7、Ka2=7.0×10-15。用NaOH溶液吸收H2S气体得到pH=10的Na2S溶液,在此过程中水的电离程度将______(填“增大”、“减小”或”不变”);此时溶液中![]() =_____________________
=_____________________
(4)加热Na2S溶液可以生成Na2S2O3,NaOH和H2,温度升高时还可生成Na2SO4,图2是含3 mol Na2S的溶液在不同温度下反应,生成H2物质的量与反应时间的关系。分析图象,完全反应后生成Na2S2O3物质的量最多的是______(填”c”或”d“)点:不考虑离子的水解,则c点溶液中浓度最高的阴离子为______(写化学式),S2O32—的物质的量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com