
【题目】已知:①H+(aq)+OH﹣(aq)═H2O(l);△H1;②2SO2(g)+O2(g)2SO3(g);△H2 . 其他条件不变时,改变反应物的量,则下列判断正确的是( )
A.△H1 , △H2都不变
B.△H1 , △H2都增大
C.△H1 , △H2都减小
D.不能确定
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】有关化学键的说法正确的是( )
A.全部由非金属元素构成的化合物一定是共价化合物
B.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键
C.金属与非金属原子间只能形成离子键
D.含有共价键的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
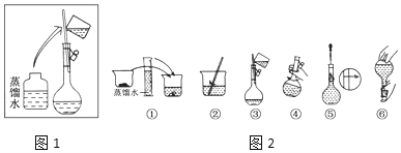
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
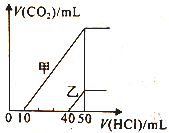
A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为OH-+H+=H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为224mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
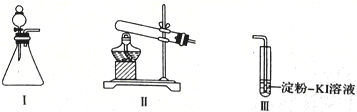
供选试剂:30%H2O2溶液、O.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向Ⅲ的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.230Th和232Th的化学性质相同
C.232Th转化成233U是化学变化
D.Th元素的相对原子质量是231
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A. 滴定管下端连有橡皮管的为酸式滴定管
B. 在滴定时,左手操作锥形瓶,右手操作滴定管开关
C. 滴定前应首先排除尖嘴部分的气泡
D. 滴定过程中两眼应注视滴定管内液面的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与不同浓度的硫酸反应时,硫酸的还原产物为SO2或H2。为验证这一事实,某同学用下图装置在室温下进行实验。
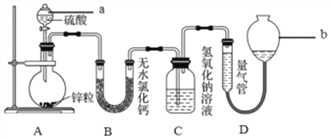
请回答下列问题:
(1)仪器a的名称是_________,若在圆底烧瓶中放入1.0g锌,选用量气管的适宜规格是(按标况计算)_____ (填字母序号)。
A.200mL B.300mL C.400mL D.500mL
(2)按上图连接好装置后,检查A装置气密性的操作是____,为使仪器a中的硫酸顺利加入圆底烧瓶,应_____并旋转活塞。
(3)实验发现:1.0g锌完全溶解后氢氧化钠洗气瓶增重0.8g,写出圆底烧瓶中发生反应的化学方程式:_________________。
(4)若ag锌与cmol/L的硫酸VL充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中, ![]() =______(用含字母的代数式表示), 若撤走B装置,
=______(用含字母的代数式表示), 若撤走B装置, ![]() 的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
(5)为准确测量气体体积,量气管在读数时应注意的操作有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com