
| A.A和M原子的电子总数之和可能为11 | B.A和M的原子序数之差为8 |
| C.A和M原子的最外层电子数之和为8 | D.A和M原子中未成对电子数相等 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 相关实验 | 预期目的 |
| A. | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 | 验证接触面积对化学反应速率的影响。 |
| B. | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中。观察气泡快慢; | 验证温度对化学反应速率的影响。 |
| C. | 常温下,直接将表面积相同的铝条和镁条投入同浓度同体积的稀盐酸中,观察产生气泡的速率。 | 比较同周期金属元素的金属性强弱。 |
| D. | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中,观察气泡。 | 比较金属活泼性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
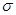 键和 个
键和 个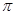 键。元素B的气态氢化的空间构型
键。元素B的气态氢化的空间构型查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
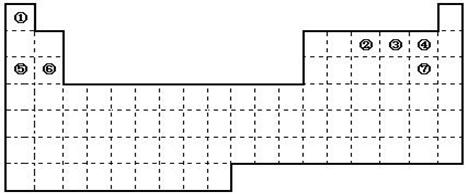
| A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示)。 |
| B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是(用化学式表示)。 |
| C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写结构式)。 |
| D.在上面元素周期表中全部是金属元素的主族是;全部是非金属元素的主族是(填写字母a、b、c、d)。 |
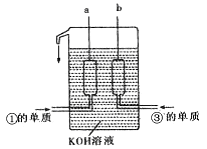
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com