
【题目】取用下列药品必须用药匙的是( )
A.盐酸B.锌粒C.碳酸钠粉末D.块状石灰石
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
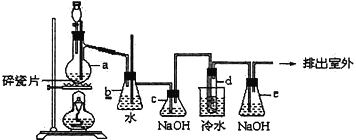
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
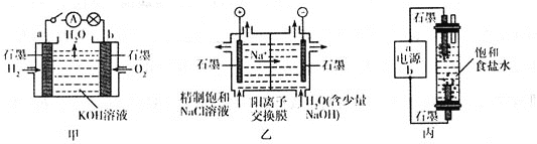
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_____________(填“正”或“负”)极,该装置内发生反应的化学方程式为___________________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子一定能够大量共存的是
A. 氢氧化铁胶体中:Na+、K+、S2-、Br-
B. 饱和FeCl3溶液:K+、NH4+、I-、Cl-
C. 含MnO4-的溶液中:Fe3+、Mg2+、SO42-、NO3-
D. 与铝作用生成H2的溶液中:Mg2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
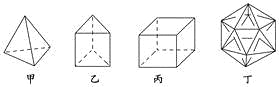
A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com