

| A. | C、D是生成物 | B. | 反应的方程式为:2A+B═2C | ||
| C. | 2min后各物质的量不再变化 | D. | 该反应不是可逆反应 |
分析 A、图象分析可知AB物质的量减小为反应物,C物质的量增大为生成物,D参与反应后物质的量不变为催化剂;
B、反应在2min达到平衡状态,为可逆反应;
C、平衡状态各物质物质的量不变;
D、反应达到平衡状态为可逆反应.
解答 解:A、图象分析可知A、B物质的量减小为反应物,C物质的量增大为生成物,D参与反应后物质的量不变为催化剂,所以D不是生成物,故A错误;
B、反应在2min达到平衡状态,物质的量不随时间不会,为可逆反应,反应的方程式为:2A+B?2C,故B错误;
C、图象分析可知,2min后,各物质的物质的量不变,说明达到平衡状态,故C正确;
D、依据B分析可知,反应达到平衡状态为可逆反应,故D错误;
故选C.
点评 本题考查了图象分析判断,化学平衡状态的分析应用,注意催化剂的理解应用,掌握基础是解题关键,题目较简单.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
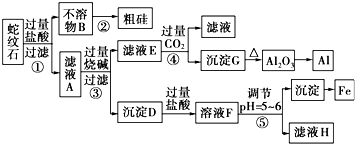
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2参加反应,转移的电子数目一定为0.2NA | |
| B. | 1.4g聚乙烯中含C-H数目为0.2NA | |
| C. | 标准状况下,5.6L甲醇中含有的分子数目为0.2NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-的数目为0.1NAA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{21n}{m-n}$ | B. | $\frac{64n}{3(m-n)}$ | C. | $\frac{m-n}{32n}$ | D. | $\frac{24n}{m-n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8有机物最多存在4个C-C单键 | |
| B. |  和 和  均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 通式相同的不同有机物一定属于同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com