


科目:高中化学 来源:不详 题型:单选题
| A.原子半径大小:Al>Mg>Na |
| B.碱性强弱:KOH>NaOH>LiOH |
| C.气态氢化物稳定性:HBr>HCl>HF |
| D.还原性强弱:F->Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
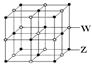
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
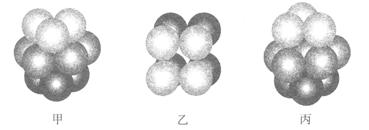
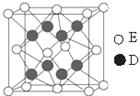
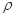 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,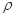 、NA的计算式表示)
、NA的计算式表示)查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
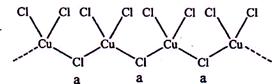
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
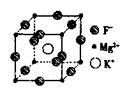
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
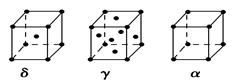
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com