
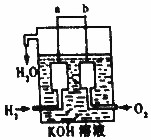
 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题分析 (1)A、水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气.
B.通过水分解产生氢气,这是可行的.
C.水分解产生氢气,但需要吸收能量.
D.开发廉价能源,以分解水制氢气,这是可行的确.
(2)氢氧燃料电池中,通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极b为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极经外电路流向正极,氢氧燃料电池的总反应为:2H2+O2=2H2O;
(3)化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,H-H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,注意氢气在氧气中燃烧,反应热△H<0,每摩尔H2O中含有2molH-O键,据此计算.
解答 解:(1)A、水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气,故A错误;
B.通过水分解产生氢气,这是可行的.故B正确;
C.水分解产生氢气,但需要吸收能量,故C错误;
D.开发廉价能源,以分解水制氢气,这是可行的,故D正确;
故选AC.
(2)氢氧燃料电池中,通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极b为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极a经外电路流向正极b;消耗标准状况下5.6L即0.25molH2,则通过导向中的电子为0.5mol,数目为:0.5NA.
故答案为:a流向b;O2+4e-+2H2O=4OH-;0.5NA;
(3)破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,
形成1mol水中的化学键释放的能量为Q3kJ,每摩尔H2O中含有2molH-O键,1molH-O键释放的能量为$\frac{1}{2}$Q3kJ,则H-O键能为$\frac{1}{2}$Q3kJ/mol,
对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,
故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×$\frac{1}{2}$Q3kJ/mol=(2Q1+Q2-2Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-2Q3)<0,所以2Q1+Q2<2Q3,故选D.
点评 本题考查了制取氢气的方法原理、氢气作为能源的主要优点、原电池工作原理的应用等知识,注意电极判断,电极反应是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 500mL,0.2mol/L 的NaCl溶液 | B. | 1 000 mL,0.1mol/L 的MgCl2溶液 | ||
| C. | 50 mL,0.2mol/L 的CaCl2溶液 | D. | 100 mL,0.1mol/L 的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,+7 | B. | 2,+6 | C. | 4,+7 | D. | 4,+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2S>HCl | B. | 离子半径:Na+>F- | ||
| C. | 酸性:H2SO4>HClO4 | D. | 离子还原性:S2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com