
| A. | 将pH=5的HCl 溶液稀释1000倍后pH变为8 | |
| B. | 将pH=8的NaOH溶液稀释1000倍后pH变为6 | |
| C. | 将 pH=2的HCl 溶液加热蒸发,体积变为原来的$\frac{1}{10}$,pH变为1 | |
| D. | 将pH=3的醋酸溶液稀释100倍后,pH<5 |
分析 A.pH=5的盐酸溶液,加水稀释,溶液的酸性随加水量而减弱,pH也就随之增大,溶液逐渐接近中性,但溶液始终为酸性溶液,即溶液的pH无限接近7但永远不能到达7;
B.将PH=8的NaOH溶液无限稀释,溶液仍然是碱性的;
C.根据PH=-lgC(H+)、c=$\frac{n}{V}$计算;
D.将PH=3醋酸溶液稀释100倍,稀释后溶液pH:3<PH<5.
解答 解:A.pH=5的盐酸溶液,加水稀释1000倍,溶液接近中性,但溶液始终为酸性溶液,即溶液的pH无限接近7但永远不能到达7,故稀释1000倍,液的pH略小于7,故A错误;
B.将PH=8的NaOH溶液稀释1000倍后,其pH接近于7,但是仍然大于7,故B错误;
C.PH=-lgC(H+),pH=2的HCl 溶液C(H+)=0.01mol/L,假设原溶液体积为10L,其氢离子物质的量为0.1mol,加热蒸发,体积变为原来的$\frac{1}{10}$,溶液体积为1L,其氢离子物质的量为0.1mol,溶液C(H+)=0.1mol/L,pH变为1,故C正确;
D.弱酸存在电离平衡,加水促进电离,稀释10n时,pH变化小于n个单位,则将pH=3的醋酸溶液稀释100倍后,3<pH<5,故D正确;
故选CD.
点评 本题考查了弱电解质的电离,注意把握酸碱溶液稀释时pH的变化规律,题目难度不大,AB选项注意酸碱无限稀释接近中性的特点.


科目:高中化学 来源: 题型:选择题
| A. | pH=4的0.1mol/L NaHA溶液:c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A) | |
| B. | 10mL 0.1mol/L CH3COOH溶液与20mL 0.1mol/L NaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1<10c2 | |
| D. | 已知:HA为弱酸,则两种溶液①0.1mol/LHA溶液;②0.3mol/LHA溶液与0.1mol/LNaOH溶液等体积的混合液,c(H+)①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
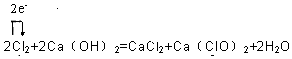 ,并用单线桥表示该反应电子转移的方向和数目.
,并用单线桥表示该反应电子转移的方向和数目. (任填一种物质的电子式)
(任填一种物质的电子式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的氢化物的沸点比W的氢化物的沸点低 | |
| C. | Y与Z 形成的化合物都可以和盐酸反应 | |
| D. | Z与Q形成的化合物的水解液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
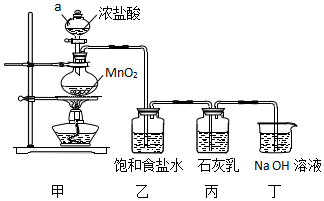
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 电负性大小:Y<Z | |
| C. | 离子半径大小:W<Y | |
| D. | W的最高价氧化物的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
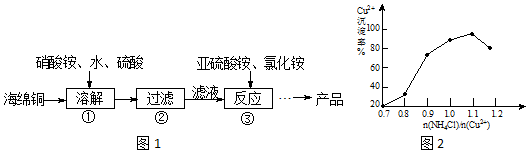
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①④⑦ | C. | ③⑤⑧ | D. | ③⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com