
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答: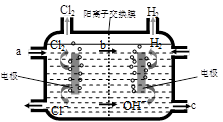
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
科目:高中化学 来源: 题型:阅读理解
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:2010年河北省正定中学高三下学期第三次考试(理综)化学部分 题型:填空题
(12分)A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热 ,氢气的燃烧热
,氢气的燃烧热 )
)
查看答案和解析>>
科目:高中化学 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:填空题
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ•g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答:
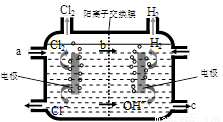
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A  B+C
在某一温度时达到平衡。
B+C
在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
查看答案和解析>>
科目:高中化学 来源: 题型:
 (9分).已知下列物质的物理常数如下:苯甲酸:白色固体,密度1.2659,熔点122℃,沸点249℃。甲醇:无色液体,密度0.7915, 熔点-97.8℃,沸点64.65℃。苯甲酸甲酯:无色液体,密度1.0888,熔点-12.3℃,沸点199.6℃。乙酸:熔点16.6℃,沸点117.9℃。乙醇:熔点一117.3℃,沸点78.5℃。乙酸乙酯:熔点-83.6℃,沸点77.1℃
(9分).已知下列物质的物理常数如下:苯甲酸:白色固体,密度1.2659,熔点122℃,沸点249℃。甲醇:无色液体,密度0.7915, 熔点-97.8℃,沸点64.65℃。苯甲酸甲酯:无色液体,密度1.0888,熔点-12.3℃,沸点199.6℃。乙酸:熔点16.6℃,沸点117.9℃。乙醇:熔点一117.3℃,沸点78.5℃。乙酸乙酯:熔点-83.6℃,沸点77.1℃
![]() (1).下图为课本上制取乙酸乙酯的实验装置图,请回答下列问题:①实验室制备乙酸乙酯的化学方程式为___________________________;
(1).下图为课本上制取乙酸乙酯的实验装置图,请回答下列问题:①实验室制备乙酸乙酯的化学方程式为___________________________;
![]()
 ②用上述装置制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有_____________;
②用上述装置制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有_____________;
![]() (2).实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了右图装置(画图时省略了铁夹、导管等仪器):①实验室制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置?
(2).实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了右图装置(画图时省略了铁夹、导管等仪器):①实验室制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置?![]() ____________________________________________;
____________________________________________;
![]() ②制得的产品含有多种杂质,如何提纯产品(只需写出所用试剂和操作名称)?
②制得的产品含有多种杂质,如何提纯产品(只需写出所用试剂和操作名称)?![]() ______________________________________________________________
______________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com