
分析 (1)①能与Na和NaOH溶液都反应的官能团是酚羟基和羧基;
②乙烯和苯、乙炔中所有原子共平面;
③常温下能与溴水发生加成反应的官能团是碳碳双键和碳碳三键;
④在一定条件下能发生酯化反应的官能团有羟基和羧基;
⑤能与新制Cu(OH)2悬浊液反应的官能团是醛基、羧基;
⑥能发生水解反应的有酯、卤代烃、多糖、蛋白质等;
(2)该分子中含有碳碳双键、醇羟基和羧基,具有烯烃、醇和羧酸的性质.
解答 解:(1)①能与Na和NaOH溶液都反应的官能团是酚羟基和羧基,ef中含有羧基,所以与Na、NaOH都反应,故选ef;
②乙烯和苯、乙炔中所有原子共平面,所以分子内所有原子在同一平面上的有乙烯和苯,故选bc;
③常温下能与溴水发生加成反应的官能团是碳碳双键和碳碳三键,bf中含有碳碳双键,能和溴发生加成反应,故选bf;
④在一定条件下能发生酯化反应的官能团有羟基和羧基,dh中含有羟基、ef中含有羧基,所以defh都能发生酯化反应,故答案为:defh;
⑤能与新制Cu(OH)2悬浊液反应的官能团是醛基、羧基,ef中含有羧基、h中含有醛基,所以能与新制Cu(OH)2悬浊液反应的有efh,故选efh;
⑥能发生水解反应的有酯、卤代烃、多糖、蛋白质等,ik中含有酯基、j属于多糖,所以能发生水解反应的有ijk,
故选ijk;
(2)该分子中含有碳碳双键、醇羟基和羧基,具有烯烃、醇和羧酸的性质,则该物质能发生加成反应、加聚反应、氧化反应、消去反应、取代反应、酯化反应、中和反应、缩聚反应,
故答案为:加成反应、加聚反应、氧化反应、消去反应、取代反应、酯化反应、中和反应、缩聚反应.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,知道常见有机物反应类型及官能团,会根据官能团确定反应类型.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
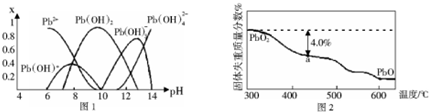
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
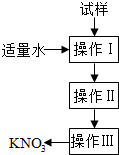
| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩.趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共需两次过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
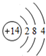 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
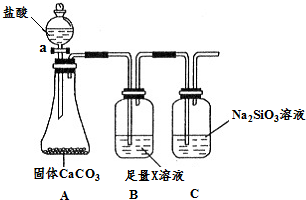
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com