
| A. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | 工业上通常用电解钠、镁、铝对应的氯化物制得该三种金属单质 | |
| C. | Si、P、S、Cl相应的氢化物的还原性依次增强 | |
| D. | 测定相同条件下NaHCO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
分析 A.硅在自然界中以化合态存在;
B.工业用电解氧化铝的方法冶炼铝;
C.非金属性越强,元素对应氢化物的还原性越弱;
D.可根据对应最高价含氧酸对应的盐溶液的酸碱性判断酸性的强弱;
解答 解:A.自然界中无游离态的硅,故A错误;
B.氯化铝为共价化合物,熔融状态下不导电,应用电解氧化铝的方法冶炼铝,故B错误;
C.Si、P、S、Cl,非金属性依次增强,相应的氢化物的还原性依次减弱,故C错误;
D.依据盐类水解规律可知:Na2CO3溶液呈碱性,说明碳酸为弱酸,Na2SO4溶液呈中性,说明硫酸为强酸,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉金属冶炼方法与金属活泼性关系及元素非金属性判断依据是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
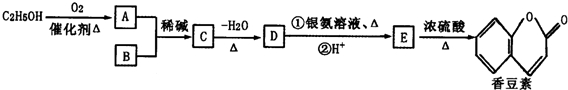
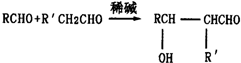 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)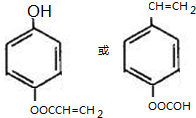 .
.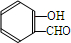 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 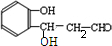 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
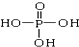 、
、 交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:
交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
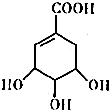 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
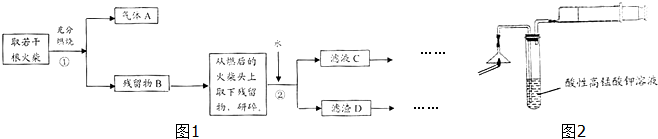
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com