
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
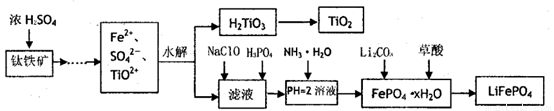
已知:H2LiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的
(2)TiO2+水解生成H2TiO3的离子方程式
(3)加入NaClO发生反应的离子方程式
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁己全部转化为二价铁离子),采取KMnO4标准液漓定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 。 (填“偏高、偏低、无影响”),滴定终点的现象 。滴定分析时,称取a g钛铁矿,处理后,用cmol/LKMnO4标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
(15分)
(1)增大固体的表面积,加快化学反应速率。(2分)
(2)TiO2+ +2H2O 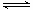 H2TiO3 ↓
+ 2H+ (2分)
H2TiO3 ↓
+ 2H+ (2分)
(3)ClO— + 2Fe2+ + 2H+ = 2Fe3+ + Cl— + H2O (3分)
(4)换上新的过滤器,将浑浊滤液重新过滤 (2分)
(5)偏高,(1分)滴加最后一滴KMnO4标准液,溶液变成紫红色,且在半分钟内不褪色为止(2分)。28cV/a%(3分)
【解析】
试题分析:工艺流程题解题的关键是要弄清楚流程中物质的转化,要能够将工艺的流程转化为物质的流程。首先钛铁矿与浓硫酸反应,溶解转化为相关离子,再水解过滤分离H2TiO3和滤液(Fe2+、SO42-等),在滤液中分离、提纯最终得到LiFePO4,最后考查到酸碱中和滴定(氧化还原滴定)相关知识。整题较为简单。
考点:以工艺流程为基础,考查了化学实验基本操作,元素及化合物知识,氧化还原滴定及误差分析及化学计算相关知识。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |

查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com