
Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,

则a的取值范围是 (3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol,乙中C的转化率 ______50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其他条件均不变,则达到平衡时:
(1)甲、乙中C的摩尔分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分别回答下列问题.
分别回答下列问题.| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
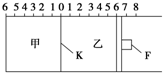 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
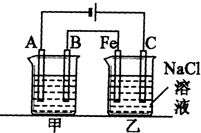
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
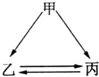 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )| A、仅①③④ | B、仅①②⑤ | C、仅①②③⑤ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com