

分析 ①甲、乙两反应装置及操作过程比较可知,甲装置容易排出污染性气体NO,乙装置无污染、反应容易控制、易操作、制备气体NO较纯净等;
②铜和稀硝酸反应生成 一氧化氮,将针筒内的溶液全部注入NaOH溶液中反应后,吸入少量的空气,一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合生成四氧化二氮属于化学平衡,聚合过程为放热反应,升温平衡逆向进行;
解答 解:①“针筒实验”进行NO气体的制备与性质实验,其主要操作是:先吸入少量水,赶尽空气(尽量少留水),然后吸入稀硝酸,封密针头,针头朝上,使其反应一段时间,然后针头朝下,使固、液体分离,甲、乙两反应装置及操作过程比较可知,甲装置容易排出污染性气体NO,乙装置无污染、反应容易控制、易操作、制备气体NO较纯净等,
故答案为:无污染、制备得到NO较纯净、实验便于控制、操作方便等;
②铜和稀硝酸反应生成一氧化氮,将针筒内的溶液全部注入NaOH溶液中反应后,吸入少量的空气,一氧化氮和氧气反应生成二氧化氮,2NO+O2=2NO2,二氧化氮聚合生成四氧化二氮属于化学平衡,2NO2?N2O4,聚合过程为放热反应,升温平衡逆向进行,体积一定,二氧化氮浓度增大,气体颜色变深,
故答案为:变深;
点评 本题考查了硝酸的性质验证、微型实验的设计和分析判断,主要是铜和硝酸反应生成的气体一氧化氮遇到氧气生成二氧化氮,二氧化氮会聚合生成四氧化二氮,温度对化学平衡的影响等,掌握基础是解题关键,题目难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
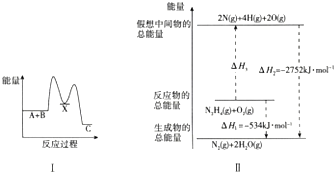
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
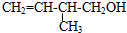
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4V正(B)=3V逆(C) | |
| B. | 单位时间消耗n mol A,同时生成3n mol C | |
| C. | 容器内气体的分子数目不变 | |
| D. | A的转化率达到最大值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a${\;}^{-\frac{1}{2}}$ | B. | a${\;}^{\frac{1}{2}}$ | C. | a2 | D. | aˉ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3COO-、Fe2+ | |
| B. | 水电离的OH-浓度为10-12mol/L的溶液中:Mg2+、NH4+、AlO2-、SO32- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(K2C2O4)=0.5mol/L溶液中:Na+、K+、MnO4-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com