
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g)??? ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)??? ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l)???? △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式?????????? 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为????????????????????????????????? 。
??? 浓度/mol·L-1
| NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 ?????????????????????? 。
②根据表中数据,计算T1℃时该反应的平衡常数为??? ??? (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率?????? (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
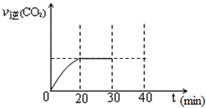
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是?????????? 。请在图中画出30min至40min 的变化曲线。

(1) CH4(g)+2NO2(g) = N2(g) + CO2(g) +2H2O(l)? ⊿H= -955 kJ·mol-1(2分)
(2) 2Fe3+ + SO2+ 2H2O = 2Fe2++ SO42- + 4H+? (2分)
(3) ① 0.009 mol·L-1·min-1(2分)
② K=0.56(2分)?? ③不变(2分)
④ C、D(2分)??? ⑤减小 CO2 的浓度(1分)
 (2分)
(2分)
【解析】
试题分析:(1)根据盖斯定律得(①+②+③×4)÷2即为所求,答案是CH4(g)+2NO2(g) = N2(g) + CO2(g) +2H2O(l)? ⊿H= -955 kJ·mol-1;
(2)根据题意可知,另一个离子方程式应是铁离子氧化二氧化硫的方程式,答案为2Fe3+ + SO2+ 2H2O = 2Fe2++ SO42- + 4H+
(3)①10min~20min之间CO2 的浓度增大了0.9mol/L,所以以v(CO2) 表示的平均反应速率为0.9mol/L/10min=0.009 mol·L-1·min-1
②反应进行到20min时达平衡,则T1℃时该反应的平衡常数为K=0.3×0.3/0.42=0.56
③恒温恒容条件下,无论NO的浓度如何变化,达到的平衡与原平衡均是等效平衡,所以NO转化率不变
④A、该反应属于反应前后气体的物质的量不变的可逆反应,所以恒容时压强一直不变,不能判定是否达平衡状态,错误;B、NO的反应速率是N2的反应速率的2倍,错误;C、达到平衡时各物质的量不再变化,所以CO2的体积分数不变,正确;D、恒容条件下,有固体参与的可逆反应中,气体的密度不变的状态是平衡状态,正确。答案选CD。
⑤由图像分析,NO的浓度减小说明平衡逆向移动,N2的浓度增大,CO2的浓度却减小,所以改变的可能条件是减小了的CO2量,对应的反应速率小于原平衡时的速率,在原速率的线下方画一条逐渐上升的曲线即可。
考点:考查盖斯定律的应用,离子方程式的书写,化学平衡中化学反应速率、平衡常数的计算、平衡状态的判断、等效平衡的判断、平衡图像的分析


科目:高中化学 来源: 题型:阅读理解

| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省白山市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在右图中画出30min至40min 的变化曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com