
| A. | 溶液中导电粒子的数目减小 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 醋酸的电离常数K随醋酸浓度减小而减小 |
分析 醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,根据醋酸的电离程度确定溶液中微粒个数变化.
解答 解:A、醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,故A错误;
B、液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=K,温度不变,K不变,故B正确;
C、加水稀释,促进电离,醋酸的电离程度增大,但氢离子浓度降低,故C错误;
D、醋酸的电离常数K只和温度有关系,加水稀释醋酸浓度减小,但是K不变,故D错误.
故选B.
点评 本题考查了弱电解质溶液加水稀释过程中离子浓度的变化,注意醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,题目难度不大.


科目:高中化学 来源: 题型:多选题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图.下列有关该氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时将电能转化为化学能 | B. | 电子从电极b经外电路流向电极a | ||
| C. | 该电池中的电极b是正极 | D. | 在电极a上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
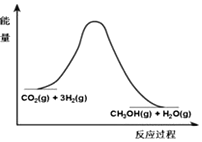 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能产生丁达尔效应 | |
| B. | 有相同的颜色 | |
| C. | 分散质颗粒直径都在1-100nm之间 | |
| D. | 加入浓氢氧化钠溶液都产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
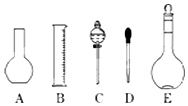 实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com