
| A、一定温度下,若等浓度的NaA,NaB溶液,pH前者大于后者,则HA,HB的Ka前者小于后者 |
| B、在一定温度下的CaSO4的水溶液中,Ca2+和SO42-浓度的乘积是一定是常数 |
| C、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
D、 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1图可表示由CO生成CO2的反应过程和能量关系 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B、铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C、FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D、在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H、D、T互为同素异形体 |
| B、氨分子中的化学键为非极性共价键 |
C、NH4Cl的电子式: |
D、S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸镁与稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
| C、大理石与盐酸反应:CO32-+2H+═CO2↑+H2O |
| D、稀硫酸与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 |
| B、铅蓄电池放电时的负极反应式为:Pb02+4H2SO4+2e-═PbSO4+2H2O |
| C、Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 |
| D、某电池的总反应为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成1mol Na2Mn5O10转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能使酸性KMnO4溶液褪色 |
| B、乙烯分子里碳、氢原子个数比为1:2 |
| C、乙烯完全燃烧生成的CO2和H2O的物质的量相等 |
| D、乙烯容易与溴水发生反应,且1 mol乙烯完全加成消耗1 mol溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
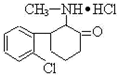 “K”粉医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性.因其物理形状通常为白色粉末,故称“K”粉.目前,该药物已被我国药检部门列为第二类精 神药品管理.其结构简式如下.
“K”粉医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性.因其物理形状通常为白色粉末,故称“K”粉.目前,该药物已被我国药检部门列为第二类精 神药品管理.其结构简式如下.| A、“K”粉的化学式为C13H10NOCl2 |
| B、1mol“K”粉在一定条件下可与4mol H2发生加成反应 |
| C、“K”粉分子中至少有7个C原子处于同一平面 |
| D、“K”粉不能与NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com