
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se-42.0 | H2Te-1.8 |
| A. | 第四组物质中H2O的沸点最高,是因为H2O分子之间存在氢键 | |
| B. | 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se | |
| C. | 第二组物质,单质的氧化性:F2>Cl2>Br2>I2 | |
| D. | 第一组物质是分子晶体,一定含有共价键 |
分析 A、结构相似的物质,熔沸点与相对分子质量成正比,但是由于水分子存在氢键,故O族元素里,水的沸点最高;
B、元素的非金属性越强,对应的氢化物越稳定;
C、元素的电负性越大,单质的氧化性越强;
D、第一组物质是0族元素,为单原子分子,不存在化学键.
解答 解:A、结构相似的物质,熔沸点与相对分子质量成正比,但是由于水分子存在氢键,水的沸点最高,故A正确;
B、元素的非金属性越强,对应的氢化物越稳定,由于非金属性Br>Se,故化合物的稳定顺序为:HBr>H2Se,故B正确;
C、电负性F>Cl>Br>I,元素的电负性越大,单质的氧化性越强,因此单质的氧化性:F2>Cl2>Br2>I2,故C正确;
D、第一组物质是0族元素,为单原子分子,不存在化学键,故D错误;
故选D.
点评 本题考查化学键和分子间作用力的区别,题目难度中等,注意氢键对物质性质的影响、元素周期律的递变规律.


科目:高中化学 来源: 题型:实验题
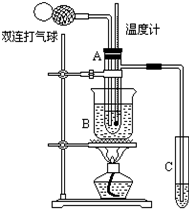 乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:
乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 78.2 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
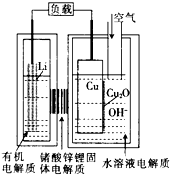 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235g的${\;}_{92}^{235}U$发生裂变反应:${\;}_{92}^{235}$U+${\;}_0^1$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_0^1$n,净产生的中子(${\;}_0^1$n)数为10NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有科学家称硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用 | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| C. | 烹饪“高价鱼”所用得植物油能使KMnO4溶液褪色,其属于高分子化合物 | |
| D. | 含有氯化钠的融雪剂的使用会加快桥梁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com