
【题目】下列关于晶体的说法正确的组合是( )
①组成金属的微粒是原子
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
【答案】D
【解析】
①金属单质属于金属晶体,金属晶体由金属阳离子和自由电子构成,故①错误;
②晶体中含有阴离子,则一定含有阳离子,但含有阳离子不一定有阴离子,如金属晶体由阳离子与自由电子构成,没有阴离子,故②错误;
③金刚石、SiC属于原子晶体,键长C-C<Si-C,故金刚石中化学键更稳定,其熔点更高;H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高;NaF、NaCl都属于离子晶体,离子半径氟离子小于氯离子,离子键更强,NaF熔点更高;熔点原子晶体>离子晶体>分子晶体,故金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故③正确;
④共价化合物一定不含离子键,但离子晶体中可能含有共价键,如氢氧化钠、过氧化钠、铵盐等,故④错误;
⑤以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用,故每个Ti4+和12个O2-相紧邻,故⑤正确;
⑥SiO2晶体中每个硅原子与4个氧原子形成4个Si-O共价键,故⑥错误;
⑦分子间作用力影响物理性质,分子稳定性属于化学性质,故⑦错误;
⑧氯化钠属于离子晶体,微粒之间作用力为离子键,熔化时破坏离子键,故⑧正确。
正确的有③⑤⑧,故选D。


科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A |
| 泡沫灭火器灭火 |
B |
| 可作面包的发泡剂 |
C | 乙酸具有酸性 | 常用于工业管道去除水垢 |
D | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
A.AB.B.C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中X2 (g)+2Y2 (g)![]() Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A.c(Z) ═0.45mol/LB.c(X2) ═0.3mol/L
C.c(X2) ═0.5mol/LD.c(Y2) ═0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(一)下列 8 组物质或粒子:
①14N 和 14C ②16O 和 18O ③氰酸铵(NH4CNO)与尿素[CO(NH2)2] ④足球烯(C60)和金刚石 ⑤CH3CH2CH2CH3 和 CH(CH3)3 ⑥CH3CH2CH3 和 CH3(CH2)2CH3 ⑦ ![]() 和
和 ![]() ⑧
⑧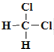 和
和![]()
(1)互为同素异形体的是__________(填编号,下同);
(2)互为同位素的是________________;
(3)互为同系物的是___________;
(4)互为同分异构体的是________________。
(二)有下列几种晶体:
A、水晶 B、冰醋酸 C、白磷 D、金刚石 E、晶体氩 F、干冰 G、氟化钠 H、过氧化钠
(1)属于原子晶体的化合物是__________________(填序号,下同);
(2)含有共价键的离子晶体是________________________;
(3)受热融化时需要克服共价键的晶体是_________________________;
(4)写出下列物质的电子式:过氧化钠_____________,二氧化碳________________。
(三)某烷烃的结构简式为:
(1)用系统命名法命名该烃:__________________________;
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构可能有 ________种(不包括立体异构,下同);
(3)若该烷烃是由炔烃加氢得到的,则原快烃的结构有_________________种;
(4)该烷烃在光照条件下与氯气反应,生成的一氧代烷最多有____________种。
(四)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。 当把 0.4mol 液态肼和0.8mol H2O2 混合反应,生成氮气和水蒸气,放出 256.7KJ 的热量(相当于 25℃、101 kPa 下测得的热量)。
①反应的热化学方程式为________________________________;
②已知 H2O(1)=H2O(g) ΔH=+44kJ/mol。
则 16g 液态肼与液态双氧水反应生成液态水时放出的热量是_________________kJ;
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① R-NO2![]() R-NH2;
R-NH2;
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
(1)A 转化为B 的化学方程式是____________________________;
(2)在“![]() ”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
(3)B 中苯环上的一氯代物有_______________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象是有机物之间普遍存在的现象,如分子式为C9H12的有机物存在多种同分异构体,![]() 和异丙苯即为其中两种。
和异丙苯即为其中两种。
(1)![]() 能使Br2的CCl4 溶液褪色,写出其与Br2 发生等物质的量加成反应时可能产物的结构简式___________________、________________、__________________;
能使Br2的CCl4 溶液褪色,写出其与Br2 发生等物质的量加成反应时可能产物的结构简式___________________、________________、__________________;
(2)异丙苯(![]() )是一种重要的有机化工原料,它的1H 核磁共振谱图中出现__________组特征峰,峰强度之比为_____________;
)是一种重要的有机化工原料,它的1H 核磁共振谱图中出现__________组特征峰,峰强度之比为_____________;
(3)C9H12还有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2 L密闭容器中充入2 mol N2和10 mol H2发生反应N2+3H2![]() 2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
A. v(N2)=3 v(H2)B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=0.5mol·L-1·min-1D. 再充入2 mol N2化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
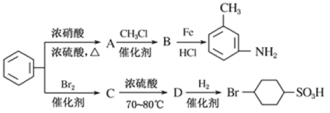
【题目】铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
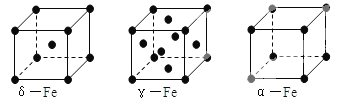
A. δ、γ、α铁晶体中存在金属阳离子和阴离子
B. γ—铁晶体晶胞中所含有的铁原子数为14
C. δ、α两种晶胞中铁原子的配位数之比为4∶3
D. 若α-Fe晶胞边长为a cm,γ-Fe晶胞边长为b cm,则两种晶体的密度比为b3∶a3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com