

 Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2 2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应. .
.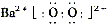 .
. BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓. BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.

科目:高中化学 来源: 题型:
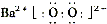
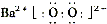
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
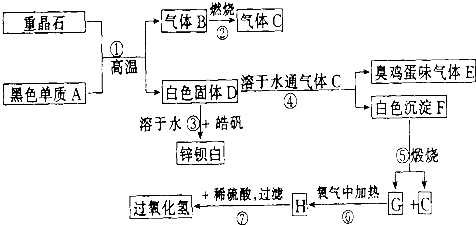
例硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢:
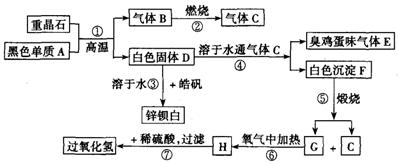
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
查看答案和解析>>
科目:高中化学 来源:天津一模 题型:问答题
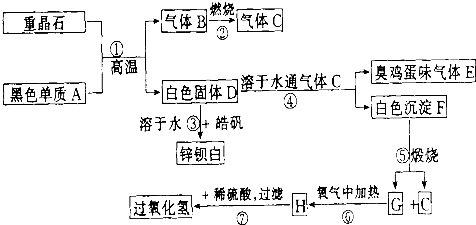
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com