
| 0.05mol��22.4L |
| 2mol |
| 0.1mol |
| 0.1L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ���� |
| ||
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ù��������Ʊ��������������ʵ��̽����
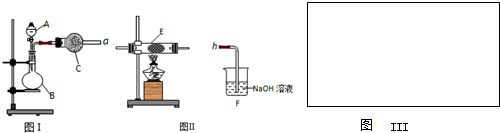
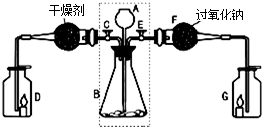
��1����0.05mol Na2O2������ƿ�У�����100mLH2O�������ϲ����������ڱ���µ����Ϊ_________L
��2��ȡ����ʵ��õ�����Һ���Թ��У�����2�η�̪��Һ����Һ���ɫ��Ƭ�̺�ɫ��ȥ��
��֪��a. ��̪��c(OH��) Ϊ1.0��10��4mol/L��2.5mol/Lʱ�ʺ�ɫ������Ϊ��ɫ��
b. H2O2���������ԡ�Ư���ԡ����ȶ��ԡ�
�� ��ͬѧ��Ϊ����ɫѸ����ȥ����������Һ��c(OH��)������ɵġ���ͨ������Ա����ݼ���˵�������۵��Ƿ���ȷ��
�����������Һ��������䣩��
![]() �� ��ͬѧ��Ϊ����ɫѸ����ȥ����������Һ�д���H2O2������Դ������Na2O2+2H2O=2NaOH+H2O2������Ƽ�ʵ��֤����ƿ����Һ�к�H2O2������ʵ������� ��
�� ��ͬѧ��Ϊ����ɫѸ����ȥ����������Һ�д���H2O2������Դ������Na2O2+2H2O=2NaOH+H2O2������Ƽ�ʵ��֤����ƿ����Һ�к�H2O2������ʵ������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com