
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
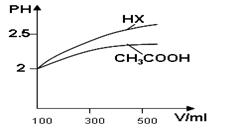
Ⅰ(1)-116 KJ/mol (2)0.0125mol/(L·min); 4; 减小。 (3)B C
Ⅱ(1)> (2)9.9×10-7;
解析试题分析:Ⅰ(1)△H=(1072+2×436-3×413-358-463)KJ/mol ="-116" KJ/mol。(2)在恒温、恒压下,P1:P2=n1:n2.12.6:8.4=3:X解得X=2. CO(g)+2H2(g)  CH3OH(g) 在反应开始时n(CO)=" 1mol;" n(H2) =2mol;n(CH3OH)=0mol.假设反应消耗CO的物质的量为a,则20min时n(CO)="(1-a)mol;" n(H2)=" (2-2a)mol;" n(CH3OH)=amol. (1-a)+(2-2a)+a=2.解得a=0.5mol.所以V(CO)=△C/△t=0.5mol÷2L÷20min= 0.0125mol/(L·min) . 该温度下平衡常数K=C(CH3OH)÷{C(CO)·C(H2)}= (0.5÷2)÷{(0.5÷2)×(1÷2)2}=4. 由于该反应的正反应是放热反应。升高温度,化学平衡向吸热反应方向即逆反应方向移动。所以化学平衡常数减小。(3)A.若反应达到平衡,则v(H2)正v(CH3OH)逆=2:1;而A选项的则为v(H2)正v(CH3OH)逆 ="1:2" 。不相等。未达到平衡。B. 该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。平均摩尔质量也不变。正确。C.该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。由于容器的容积不变,所以容器中气体的压强保持不变 。正确。D.无论反应是否达到平衡,在任何时刻,每生成nmolCO的必同时生成2nmolH2。错误。故正确选项为B、C。Ⅱ(1)当溶液稀释时溶液的酸性越强,PH变化就越大。故Ka(HX) >Ka(CH3COOH)。(2)由于溶液呈电中性,所以C(Na+)+C(H+)=C(OH-)+C(CH3COO-).25℃时,Kw=10-14,CH3COOH与CH3COONa的混合溶液的pH=6,C(H+)=10-6,则C(OH-)="Kw/" C(H+)=10-14÷10-6=10-8。则溶液中C(CH3COO?)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7(mol/L).
CH3OH(g) 在反应开始时n(CO)=" 1mol;" n(H2) =2mol;n(CH3OH)=0mol.假设反应消耗CO的物质的量为a,则20min时n(CO)="(1-a)mol;" n(H2)=" (2-2a)mol;" n(CH3OH)=amol. (1-a)+(2-2a)+a=2.解得a=0.5mol.所以V(CO)=△C/△t=0.5mol÷2L÷20min= 0.0125mol/(L·min) . 该温度下平衡常数K=C(CH3OH)÷{C(CO)·C(H2)}= (0.5÷2)÷{(0.5÷2)×(1÷2)2}=4. 由于该反应的正反应是放热反应。升高温度,化学平衡向吸热反应方向即逆反应方向移动。所以化学平衡常数减小。(3)A.若反应达到平衡,则v(H2)正v(CH3OH)逆=2:1;而A选项的则为v(H2)正v(CH3OH)逆 ="1:2" 。不相等。未达到平衡。B. 该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。平均摩尔质量也不变。正确。C.该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。由于容器的容积不变,所以容器中气体的压强保持不变 。正确。D.无论反应是否达到平衡,在任何时刻,每生成nmolCO的必同时生成2nmolH2。错误。故正确选项为B、C。Ⅱ(1)当溶液稀释时溶液的酸性越强,PH变化就越大。故Ka(HX) >Ka(CH3COOH)。(2)由于溶液呈电中性,所以C(Na+)+C(H+)=C(OH-)+C(CH3COO-).25℃时,Kw=10-14,CH3COOH与CH3COONa的混合溶液的pH=6,C(H+)=10-6,则C(OH-)="Kw/" C(H+)=10-14÷10-6=10-8。则溶液中C(CH3COO?)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7(mol/L).
考点:考查反应热、化学反应速率、平衡常数的计算及外界条件对化学平衡的影响、离子浓度比较的知识。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。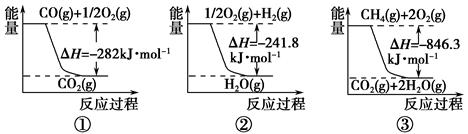
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。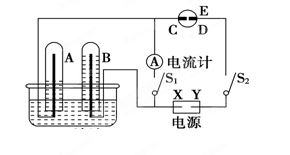
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)25℃、101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为: 。
(2)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),写出该极的电极反应式 。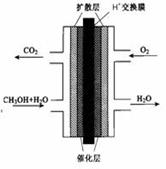
(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成 。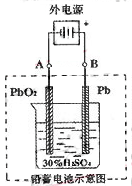
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.已知:反应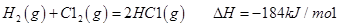
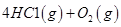
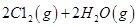

请回答: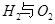 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: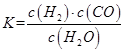
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应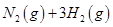
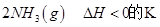 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应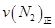 ____________
____________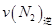 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
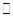
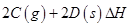 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
请完成下列问题:
①判断该反应的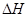 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A. B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
依据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 _________________________________________________。
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下: 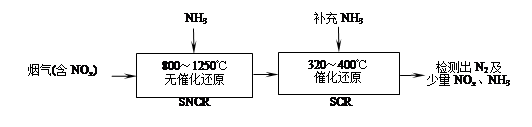
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。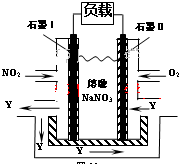
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: 。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下: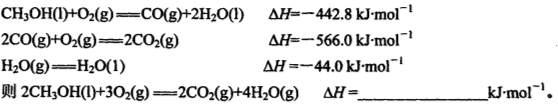
(2)工业上正在研究利用来生产甲醇燃料的方法,该反应为: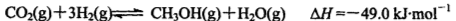
在某温度下,将6mol CO2和8molH2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
②用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH)=____.
②此温度下该反应平衡常数K=____________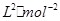 mol;
mol;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率____________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳与氢气也可以合成甲醇: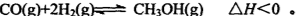
①若该反应在恒温恒容条件下进行,下列说法正确的是____;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2/mol2,反应到某时刻测得各组分的物质的量如下:
请比较此时正、逆反应速率的大小: (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com