
| 分类 | 名称(或俗名) | 化学式 | |
| A | 碱性氧化物 | 氧化碳 | FeO |
| B | 酸性氧化物 | 一氧化碳 | CO |
| C | 酸 | 亚硫酸 | H2S |
| D | 盐 | 纯碱 | Na2CO3 |
| A、A | B、B | C、C | D、D |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
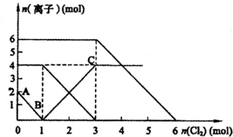 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、44% |
| C、55% | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向一份中加铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中加铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向一份中加铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中加铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、混合酸中NO的物质的量为0.2 mol |
| B、OA段产生的是NO,BC段产生氢气 |
| C、溶液中最终溶质为FeSO4 |
| D、c(H2SO4)为4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:6;Na2CO3和NaHCO3 |
| B、2:1:4;Na2CO3 |
| C、1:2:6; Na2CO3和NaOH |
| D、2:1:4; Na2CO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com