
【题目】1,3﹣丁二烯(CH2=CHCH=CH2)和2﹣丁炔(CH3C CH3)是重要的有机原料.
已知:Ⅰ.CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)△H1=﹣236.6kJmol﹣1
Ⅱ.CH3C CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)△H=﹣272.7kJmol﹣1
Ⅲ.C﹣C的键能为348kJmol﹣1;C=C的键能为612kJmol﹣1
请回答:
(1)CH2=CHCH=CH2(g)转化为CH3C CCH3(g)的热化学方程式为 . C C的键能为kJmol﹣1 .
(2)T1℃时,向10L恒容密闭容器中充入1.0molCH2=CHCH=CH2(g)和2.0molH2(g),发生反应Ⅰ.5min达到平衡,测得容器内CH3CH2CH2CH3(g)的物质的量为0.60mol.则:
①0~5min内,用H2表示的该反应速率v(H2)= .
②T1℃时,该反应的平衡常数K=(保留四位有效数字).
③下列事实能说明该反应达到平衡状态的是(填选项字母).
A.容器内气体压强不再改变
B.容器内气体密度不在改变
C.CH2=CHCH=CH2(g)和H2(g)的体积分数之比为1:2
D.容器内气体平均摩尔质量不再改变
(3)一定条件下,向密闭容器中冲入一定量的CH3C CCH3(g)和H2(g),发生反应Ⅱ,CH3C CCH3(g)的平衡转化率(α)与温度(T)和压强(P)的关系如图所示.
①P1P2(填“>”“<”或“=”,下同)
②a、b两点的平衡常数:K(a)K(b).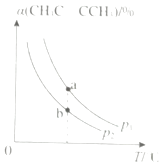
【答案】
(1)CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJ?mol﹣1;839.9
(2)0.024mol?L﹣1?min﹣1;234.4;AD
(3)>;=
【解析】解:(1)已知::Ⅰ.CH2=CHCH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)△H1=﹣236.6kJmol﹣1Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)△H=﹣272.7kJmol﹣1
由盖斯定律Ⅰ﹣Ⅱ可得CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJmol﹣1;设C≡C的键能为x,C﹣C的键能为348kJmol﹣1;C=C的键能为612kJmol﹣1 , 反应前后的C﹣H相等,则x+348×2﹣612×2﹣348=﹣36.1,解得x=839.9kJmol﹣1;
所以答案是:CH2=CHCH=CH2(g)→CH3C≡CCH3(g)△H=+36.1kJmol﹣1;839.9;(2)①平衡时容器内CH3CH2CH2CH3(g)的物质的量为0.60mol,参加反应的氢气的物质的量为1.2mol,则0~5min,v(H2)= ![]() =0.024molL﹣1min﹣1;
=0.024molL﹣1min﹣1;
所以答案是:0.024molL﹣1min﹣1;
②得容器内CH3CH2CH2CH3(g)的物质的量为0.60mol,列三段式:
CH2=CHCH=CH2(g)+ | 2H2(g) | → | CH3CH2CH2CH3(g) | |
c始: | 0.1 | 0.2 | 0 | |
c转: | 0.06 | 0.12 | 0.06 | |
c平: | 0.04 | 0.08 | 0.06 |
则此温度下化学平衡常数K= ![]() ≈234.4;
≈234.4;
所以答案是:234.4;③A.该反应左右两边均为气体且气体分子总数不等,容器内气体压强改变,不再改变时,反应达到平衡,故A正确;
B.容器内混合气体的总质量不变,恒容气体体积不变,则密度始终不变,故B错误;
C.CH2=CHCH=CH2(g)和H2(g)的体积分数之比为1:2并保持不变,故C错误;
D.容器内混合气体的总质量不变,气体总的物质的量减小,平均摩尔质量改变,不再改变时,反应达到平衡,故D正确;
所以答案是:AD;(3)①反应Ⅱ.CH3C≡CCH3(g)+2H2(g)→CH3CH2CH2CH3(g)是个气体体积减小的反应,增大压强,平衡正向移动,②CH3C≡CCH3的转化率增大,从图可知,相同温度下,P1 的转化率大于的P2转化率,则P1>P2;
所以答案是:>;
②a、b两点的温度相同,则化学平衡常数相等;
所以答案是:=.
【考点精析】认真审题,首先需要了解化学平衡状态的判断(状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A. E(5s)>E(4f)>E(4s)>E(3d)
B. E(3d)>E(4s)>E(3p)>E(3s)
C. E(4s)<E(3s)<E(2s)<E(1s)
D. E(5s)>E(4s)>E(4f)>E(3d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子和原子的说法,不正确的是
A. 分子在化学反应前后种类和数目保持不变
B. 分子在不停地运动
C. 原子可以直接构成物质
D. 原子是化学变化的最小粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是
A. 利用太阳能使海水蒸馏淡化
B. 加明矾使海水中的盐分沉淀而淡化
C. 利用电渗析法可以获取淡化的饮用水
D. 将海水通过离子交换树脂,以除去所含离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(结构如图)的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面,其中正确的是( ) ![]()
A.仅①②④⑤
B.仅①②⑤⑥
C.仅①②④⑤⑥
D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算: ①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( ) 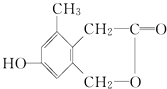
A.该有机物1 mol 能与3 mol H2在镍作催化剂条件下发生加成反应
B.该有机物1 mol 能与1 mol H2在镍作催化剂条件下发生加成反应
C.该有机物能与NaHCO3反应放出CO2
D.该有机物在一定条件下能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com