
工业制硝酸的主要反应为
4NH3(g)+5O2(g) 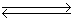 4NO(g)+6H2O(g) ΔH。
4NO(g)+6H2O(g) ΔH。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol;
H2O(l)===H2O(g) ΔH=+44.0 kJ/mol;
N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的ΔH=____________________。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为__________________。
②反应在第6 min时改变了条件,改变的条件可能是__________(填序号)。
A.使用催化剂 B.升高温度
C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
(1)-904.8 kJ·mol-1
(2)①0.187 5 mol/(L·min) ②B ③ABE
[解析] (1)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol ①
N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol ②
H2O(l)===H2O(g) ΔH=+44.0 kJ/mol ③
N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ/mol ④
根据盖斯定律①×3+④×2+③×6-②×2得4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-904.8 kJ·mol-1。
(2)①v(O2)=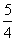 v(NH3)=
v(NH3)=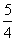 ×
×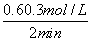 =0.187 5 mol/(L·min)。
=0.187 5 mol/(L·min)。
②6 min~8 min各物质的浓度并未发生变化,而达到平衡时反应物浓度增大,生成物浓度减小,故平衡逆向移动,A、D项错误。该反应是反应后气体化学计量数之和增大的反应,也是放热反应。升高温度平衡逆向移动,减小压强平衡正向移动,B项正确,C项错误。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
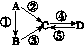
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:
__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:________________________________________________________________________。
D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180 s与180~240 s 区间的平均反应速率________、________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________(要求写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
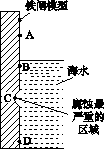
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
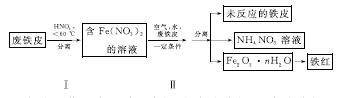
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:( )
2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | |||
| 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是____________,当生成标准状况下35.84 L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100 L的反应室,CH4的平衡转化率与温度、压强的关系如图K235所示。
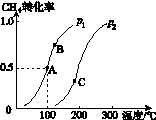
图K235
①若达到A点所需的时间为5 min,则v(H2)=________________________________________________________________________,
100 ℃时平衡常数K=____________________。
②图中的p1______p2(填“<”“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是________________________________________________________________________。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g) 
 CO2(g)+H2(g) ΔH<0,下列措施中能使
CO2(g)+H2(g) ΔH<0,下列措施中能使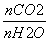 增大的是________(选填编号)。
增大的是________(选填编号)。
A.降低温度
B.恒温恒容下充入He(g)
C.将H2从体系中分离
D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中由水电离的OH-的物质的量浓度为________________________________________________________________________,
常温下,0.1 mol·L-1 KHCO3溶液中pH>8,则溶液中c(H2CO3)________c(CO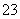 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
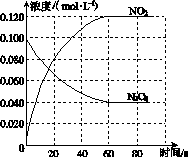
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com