
(14分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1) 上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Cu原子的核外电子排布式_____
(2) 根据等电子原理,写出CO分子的结构式_______________。
(3) 甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
② 甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
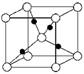
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2
(2)C≡O(或C O)
O)
(3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4
【解析】(1)根据构造原理可知,Cu原子的核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。
(2)电子数和原子数分布都相同的是等电子体,所以CO和氡气是等电子体,因此结构式为C≡O(或C O)。
O)。
(3)①甲醇分子中含有氢键,所以沸点高于甲醛的。甲醛是平面型结构,所以碳原子是sp2杂化。
②甲醛是平面三角形结构。由于双键是由1个σ键和1个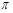 键构成的,所以1mol甲醛分子中σ键的数目为3NA。
键构成的,所以1mol甲醛分子中σ键的数目为3NA。
③根据晶胞的结构可知,铜原子全部在晶胞内,因此共有4个。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com