
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 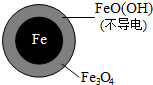 |  |
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
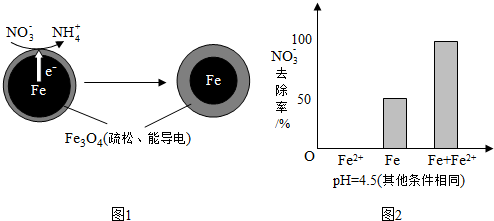
分析 (1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;
(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;
(3)①根据图2中的三个实验结果进行分析;
②结合(2)题中的铁的最终物质形态结果差异进行分析;
(4)根据Fe2+的作用进行分析.
解答 解:(1)①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低.
故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移;
(4)根据实验结果可知Fe2+的作用是将不导电的FeO(OH)转化为可导电的Fe3O4,而NO3-的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响Fe2+的含量.
故答案为:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
点评 考查化学反应原理,涉及电化学、氧化还原反应等相关知识,题中的Fe与NO3-的反应跟溶液酸碱性有关,抓住这一点是解题的关键,第Ⅱ问的解答有一定的难度,特别是阐述上的准确性.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 50mL12mol/L的盐酸与足量MnO2共热,转移电子数为0.3NA | |
| D. | 2.0gH218O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的NaOH溶液和pH=4的盐酸溶液中,水的电离程度 | |
| B. | 将pH=3的盐酸和醋酸分别稀释成pH=5的溶液,需加水的体积 | |
| C. | 10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 | |
| D. | 等体积pH相等的醋酸和盐酸,分别与过量的锌粉反应产生的H2的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com