
20℃时,NaCl溶解度为36g,此时NaCl饱和溶液的密度为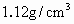 ,在此温度下NaCl饱和溶液中NaCl的物质的量浓度为
,在此温度下NaCl饱和溶液中NaCl的物质的量浓度为
[ ]
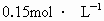
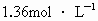
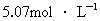
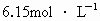
科目:高中化学 来源: 题型:
| 物质 | Ba(NO3)2 | NH4Cl | BaCl2 | NH4NO3 | NaCl | Ba(OH)2 |
| 溶解度 | 8.3 | 27.3 | 26.3 | 63.5 | 26.4 | 4.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
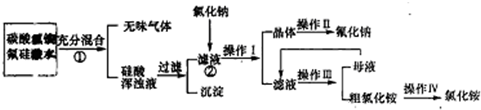
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
(2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com