
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ������һ�ַ�Ӧԭ�����£�CH3OH(g)��H2O(g)=CO2(g)��3H2(g)��H����49��0 kJ��mol��1
����˵����ȷ���ǣ� ��
| A��1 L CH3OH������1 Lˮ������Ӧ����1 L CO2������3 L������������49��0 kJ |
| B��1��CH3OH������1��ˮ���ӷ�Ӧ����1��CO2������3��H2��������49��0 kJ���� |
| C����ͬ������1 mol CH3OH(g)��1 mol H2O(g)�������ܺ�С��1 mol CO2(g)��3 mol H2(g)�������ܺ� |
| D��1 mol CH3OH������1 molҺ̬ˮ��Ӧ����1 mol CO2������3 mol�������յ�����С��49��0 kJ |
 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵�����ʾ������ȷ����
| A�������������������������ֱ���ȫȼ�գ����߷ų������� |
| B���ɡ���(ʯī)����(���ʯ) ��H=1.9kJ/mol����֪�����ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У���+(aq)+OH-(aq)��H2O(l) ��H=-57.3kJ/mol��������1molCH3COOH�뺬��mol NaOH����Һ��ϣ��ų�������С�ڣ���.3kJ |
| D����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)��2H2O(l) ��H=��285.8kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���з�Ӧһ�����ڷ��ȷ�Ӧ����(����)��
| A����������������Ȼ�茶���ķ�Ӧ |
B�������仯��ͼ��ʾ�ķ�Ӧ |
| C����ѧ���������յ������Ȼ�ѧ���γɷų��������ٵķ�Ӧ |
| D������Ҫ���Ⱦ��ܷ����ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ij������˾�������������������ڽϵ��¶��½�����ת������ϩ��2CH4(g)??C2H4(g)��2H2(g)����H����֪�ڽ����¶�ʱ�÷�Ӧƽ�������ƶ�����������������Ӧ(Q1��Q2��Ϊ��ֵ)��
��Ӧ��C(s)��2H2(g)=CH4(g)����H1����Q1
��Ӧ��C(s)��H2(g)= C2H4(g)����H2����Q2
C2H4(g)����H2����Q2
�������ж���ȷ����(����)
| A����H��0 | B��Q2��Q1 | C����H��2(Q1��Q2) | D����H��Q1��Q2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��Ӧ����101 kPaʱ��2C(s)��O2(g)=2CO(g)����H����221 kJ��mol��1
��ϡ��Һ�У�H��(aq)��OH��(aq)=H2O(l)��H����57.3 kJ��mol��1
��H2(g) O2(g)=H2O(g)��H����241.8 kJ��mol��1
O2(g)=H2O(g)��H����241.8 kJ��mol��1
��H2O(g)=H2O(l)��H����44.0 kJ��mol��1
���н�����ȷ����(����)
| A��̼��ȼ���ȴ���110.5 kJ��mol��1 |
| B��Ũ������ϡNaOH��Һ��Ӧ����1 molˮ���ų�57.3 kJ���� |
| C��������ȼ����Ϊ241.8 kJ��mol��1 |
| D��2H2(g)��O2(g)=2H2O(l)�ķ�Ӧ��Ϊ��H����571.6 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Դ�ǵ�����ᷢչ������֧��֮һ����ר�����������ܹ�����̫����ʹȼ��ȼ�ղ���(��CO2��H2O��N2��)�������(����ͼ)�����Խ�Լȼ�ϣ�������ԴΣ�����ڴ˹��������ѭ����̫��������ת��Ϊ�� ��
| A����ѧ�� | B������ | C�������� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪:��2H2(g)+O2(g) 2H2O(g)��H="-483.6" kJ/mol
2H2O(g)��H="-483.6" kJ/mol
��H2(g)+S(g)=H2S(g) ��H="-20.1" kJ/mol�������ж���ȷ���ǣ� ��
| A��1 mol������ȫȼ������241.8 kJ |
| B��1 mol H2O(g)��1 mol H2S(g)���������221.7 kJ |
| C���ɢ٢�֪,ˮ�����ȶ���С������ |
| D������Ӧ���и��ù�̬��,1 mol S(s)��ȫ��Ӧ,�ų�������С��20.1 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�Ц�H1>��H2���ǣ���������
| A��2H2��g����O2��g��=2H2O��l������H1 2H2��g����O2��g��=2H2O��g������H2 |
| B��S��g����O2��g��=2SO2��g������H1S��s����O2��g��=2SO2��g������H2 |
C��C��s����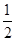 O2��g��=CO��g������H1 C��s����O2��g��=CO2��g������H2 O2��g��=CO��g������H1 C��s����O2��g��=CO2��g������H2 |
D��H2��g����Cl2��g��=2HCl��g������H1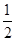 H2��g���� H2��g����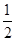 Cl2��g��=HCl��g������H2 Cl2��g��=HCl��g������H2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com