
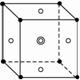
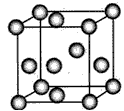
·表示A原子
○表示B原子(前后两面上的B原子未画出)
◎表示C原子
A. 8∶6∶1 B. 4∶3∶
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
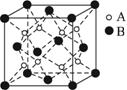
A.B2A B.BA2 C.B7A4 D.B4A7
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)确定该合金的化学式_____________。
(2)若晶体的密度为ρ g·cm-3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为_____________cm。
(3)取该合金粉末2.78 g溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L(标准状况)NO气体(设两者恰好完全反应),则原硝酸溶液的物质的量浓度为__________ mol·L-1,反应后溶液中Fe3+离子的物质的量浓度为_____________mol·L-1(假定溶液体积变化忽略不计)。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省原名校高三下学期第一次联考化学试卷(解析版) 题型:推断题
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。
B元素原子的核外p电子数比s电子数少1。
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol
I4=10540kJ/mol
D原子核外所有p轨道全满或半满。
E元素的主族序数与周期数的差为4。
F是前四周期中电负性最小的元素。
G在周期表的第七列。
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
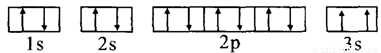
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。

查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com