
25℃ 时,水的离子积为Kw ,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤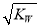 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1
C. a = b D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
在2A+2B C+5D反应中,表示该反应速率最快的是( )
C+5D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.4 mol/(L·s) D.v(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g)  2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
A.10mol 10% B.20mol 20% C.20mol 40% D.30mol 80%
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是
A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+
B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
C.“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O=CO32-+2HClO
D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B ,G 。
(2)写出F的价电子排布图: 。
(3)写出化合物BC的结构式: 。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是 。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是 。
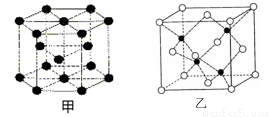
(6)E的一种晶体结构如图甲,则其一个晶胞中含有 个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为 pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述正确的是
A.14 gC2H4和C3H6的混合气体中含有的原子数为3NA
B.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.2NA个氢氧根离子
C.5.6克铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA
D.1.0L1mol/L的NaOH水溶液中含有的氧原子数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)实验室制备NH3的化学方程式是: 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
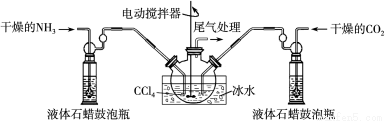
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
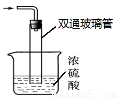 ②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性由强到弱顺序为:HXO4>H2YO4>H3ZO4,下列判断错误的是
A.原子半径 X>Y>Z B.气态氢化物稳定性X>Y>Z
C.元素原子得电子能力X>Y>Z D.单质与氢气反应难易X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过
A.加成反应 B.取代反应 C.聚合反应 D.催化裂化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com