
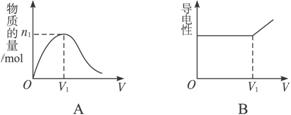
(1)图A表示溶液中_____________________________离子的变化曲线,说明曲线下降的原因:_____________________________________________________________________。
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是___________。
(3)当n=0.02 mol时,光照前的混合气体中H2和Cl2的物质的量之比为___________。
(1)ClO- 当通入的气体开始过量时,溶液呈酸性,发生反应:H++ClO-![]() HClO,使n(ClO-)减少
HClO,使n(ClO-)减少
(2)H+ (3)3∶5
解析:混合气体中H2和Cl2的物质的量之比可以等于1∶1,或大于1∶1,或小于1∶1,只有当小于1∶1时,混合气体经光照充分反应后,通入到NaOH溶液中发生反应:HCl+NaOH====NaCl+H2O,Cl2+2NaOH====NaCl+NaClO+H2O,过量的HCl与NaClO反应生成HClO和NaCl,n(ClO-)才先增后减。但是,由于ClO-+H+![]() HClO,n(ClO-)不会减少到为0,n(ClO-)=0.02 mol,依据方程式:
HClO,n(ClO-)不会减少到为0,n(ClO-)=0.02 mol,依据方程式:
Cl2 + 2NaOH====NaCl+NaClO +H2O,
0.02 mol 0.04 mol 0.02 mol
NaOH + HCl====NaCl+H2O,
(0.1-0.04) mol 0.06 mol
H2 + Cl2 ==== 2HCl,
0.03 mol 0.03 mol 0.06 mol
因此光照前的混合气体中H2和Cl2的物质的量之比为0.03 mol∶(0.02 mol+0.03 mol)=3∶5。


科目:高中化学 来源: 题型:
(1)通过计算,将计算结果填入下表:
| H2和Cl2物质的量的关系 | 生成NaCl的物质的量 |
① | n(H2)=n(Cl2) |
|
② | n(H2)>n(Cl2) |
|
(2)推断当n(H2)<n(Cl2)时,生成NaCl的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
由H2和Cl2组成的混合气体,经光照充分反应后,通入到100 mL 1 mol·L-1的NaOH溶液中,图A表示溶液中某种离子的物质的量随着通入气体体积的变化而变化的曲线,图B表示溶液中的导电性随着通入气体体积的变化而变化的曲线。

(1)图A表示溶液中_____________________________离子的变化曲线,说明曲线下降的原因:____________________________________________________________________________。
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是___________。
(3)当n=0.02 mol时,光照前的混合气体中H2和Cl2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源:黄冈中学2010届高三6月适应性考试理综能力测试化学A卷 题型:选择题
由H2和Cl2组成的混合气体经光照充分反应后,通入1000mL0.1 mol/L的NaOH溶液中,图甲表示某种离子的物质的量随通入气体的体积变化曲线。当n=0.02mol时,光照前的混合气体中H2和Cl2的物质的量的之比为 ( )
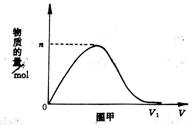
A.4∶3 B.7∶3
C.3∶5 D.3∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com