
| A. | ①② | B. | ②③ | C. | ①③ | D. | ② |
分析 ①根据溶液的体积不等于溶剂的体积来分析;
②80.5g Na2SO4•10H2O物质的量为$\frac{80.5g}{322g/mol}$=0.25mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,根据c=$\frac{n}{V}$计算判断;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,据此计算稀释后浓度.
解答 解:①溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②80.5g Na2SO4•10H2O物质的量为$\frac{80.5g}{322g/mol}$=0.25mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=$\frac{0.25mol}{0.25L}$=1.0mol•L-1,故②正确;
③根据稀释前后溶质硫酸钠的物质的量不变,则50ml×5.0mol/L=250mL×c,则c=1.0mol/L,故③正确.
故选B.
点评 本题主要考查配制一定物质的量浓度的溶液的配制及对物质的量浓度的理解、计算,难度不大,注意配制中物质溶于水溶质发生变化的情况以及稀释前后溶质的物质的量不变.


科目:高中化学 来源: 题型:选择题
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子2 mol | |
| C. | Na2O2只作氧化剂 | |
| D. | Na2O2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质铜与浓硝酸反应:Cu+2H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 氯气与氢氧化钠浓溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 氯化铵溶液与氢氧化钠溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M g | B. | $\frac{1}{M}$ g | C. | $\frac{M}{6.02×1{0}^{23}}$ g | D. | $\frac{6.02×1{0}^{23}}{M}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6mol/L | B. | 2mol/L | C. | 2.8 mol/L | D. | 4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
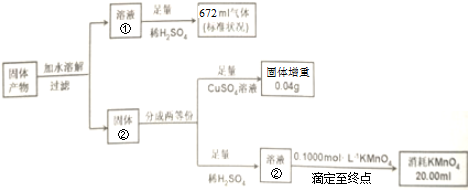
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com