
 .
. .
.分析 有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl,据此解答.
解答 解:有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl,
(1)A为碳元素,最高价氧化物为CO2,电子式为 ,
,
故答案为: ;
;
(2)B为氧元素,在周期表中的位置:第二周期VIA族,
故答案为:第二周期VIA族;
(3)B单质与C单质在点燃时反应的生成物为Na2O2,含有离子键、非极性共价键(或共价键),
故答案为:离子键、非极性共价键(或共价键);
(4)过氧化钠与二氧化碳反应方程式为:2CO2+2 Na2O2=2 Na2CO3+O2,
故答案为:2CO2+2 Na2O2=2 Na2CO3+O2;
(5)C与D能形成2:1的化合物为Na2S,用电子式表示该化合物的形成过程: ,
,
故答案为: ;
;
(6)同周期自左而右元素非金属性增强,故非金属性Cl>S,
a.单质状态属于物理性质,不能比较元素非金属性,故a错误;
b.氢化物稳定性与元素非金属性一致,氯化氢比硫化氢稳定,说明氯的非金属性更强,故b正确;
c.与变价金属反应可以根据产物中金属化合价判断非金属元素的非金属性强弱,Na不是变价金属,不能判断硫与氯的非金属性强弱,故c错误;
d.最高价含氧酸的酸性与中心元素的非金属性一致,故d正确;
e.硫不能与HCl反应生成氯气,故e错误,
故答案为:Cl;bd.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实,试题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
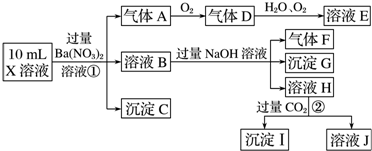
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
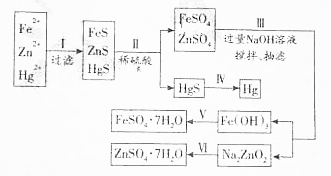
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
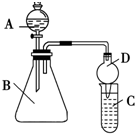 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com