
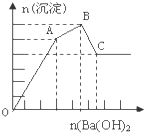
 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |


科目:高中化学 来源: 题型:
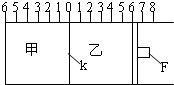 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 周 族 期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:

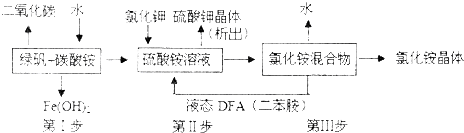
| A、X中不能确定的离子是 A13+、Na+、K+和C1- |
| B、气体F经催化氧化可直接生成气体D |
| C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 |
| D、X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与甲酸甲酯互为同分异构体 | ||||
B、
| ||||
| C、氧气与臭氧互为同素异形体 | ||||
| D、乙烯与聚乙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
| B、碳酸钙与稀盐酸的反应:CO32-+2H+=CO2+H2O |
| C、氨水与盐酸反应:OH-+H+=H2O |
| D、实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com