
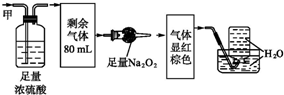
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
分析 某无色混合气体甲,可能含NO、NO2、NH3、CO2、N2中的几种,二氧化氮是红棕色的气体,一定不含有NO2,浓硫酸可以和氨气反应,二氧化碳可以和过氧化钠反应生成氢氧化钠和氧气,一氧化氮无色,与氧气立即反应变为红棕色的二氧化氮,氮气不溶于水.
解答 解:某无色混合气体甲,可能含NO、NO2、NH3、CO2、N2中的几种,二氧化氮是红棕色的气体,一定不含有NO2,100 mL气体甲经过浓硫酸时,20mL的氨气被吸收,通入足量的过氧化钠,假设有ymL的二氧化碳被足量的过氧化钠吸收,并且生成$\frac{1}{2}$ymL氧气,此时一氧化氮和氧气必须满足NO:O2=4:3的关系,才可以保证最终没有气体剩余,从过氧化钠逸出之后整个过程中发生的总反应为4NO+3O2+2H2O=4HNO3.所以一定不含N2,
设原气体含有NOxmL,
则x:$\frac{1}{2}$y=4:3,
x+y=100-20=80,
解得x=32,y=48,
上述推断得到原混合气体成分为:NH3 20mL、NO 32mL、CO248mL,
故选B.
点评 本题考查常见气体的检验和性质,是一道气体的鉴别题目,注意氨气的碱性、注意二氧化碳和过氧化钠的反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1.685mol•L-1 | B. | 3.370 mol•L-1 | C. | 22.49 mol•L-1 | D. | 11.24 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
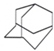 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向该混合溶液中加入适量H2O2,并调节pH到3~4后过滤可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com