
(4分)以铜为阳极,石墨为阴极,用含3~5gNaOH的15%NaCl的混合溶液做电解液,外加电压为1.5V电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为 ① ,阴极反应式为 ② ;电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征: ③ 和 ④ 。
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:

|

| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
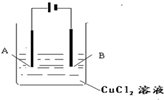 按右图所示装置,以石墨为电极电解氯化铜溶液.
按右图所示装置,以石墨为电极电解氯化铜溶液.查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com