
| A. | MgO、Al2O3熔点高,均可用作耐高温材料 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
分析 A.耐高温材料应具有较高的熔点;
B.碳酸氢铵中含有铵根离子,其中的氮元素能被植物吸收;
C.依据盐类水解性质解答;
D.依据二氧化硫的漂白性解答.
解答 解:A.MgO、Al2O3熔点高,均可用作耐高温材料,故A正确;
B.碳酸氢铵中含有铵根离子,其中的氮元素能被植物吸收,可以做氮肥,与其受热分解的性质无关,故B错误;
C.硫酸铁做净水剂是因为三价铁离子水解生成具有吸附性氢氧化铁胶体,能够吸附水中固体杂质颗粒,故C错误;
D.二氧化硫能够与有机色素化合生成无色物质而具有漂白性,能够漂白纸浆,与其氧化性无关,故D错误;
故选:A.
点评 本题考查物质的性质及用途,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
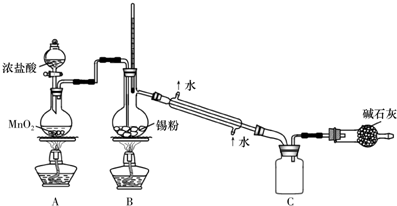
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
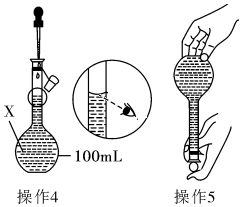 某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:
某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
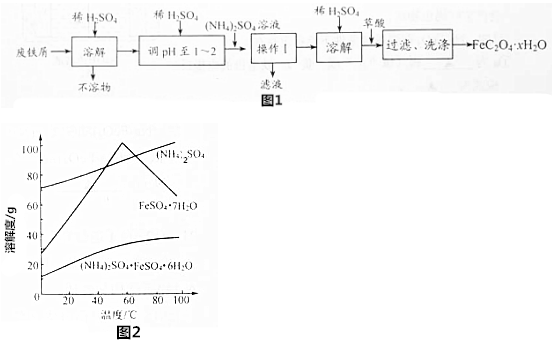
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
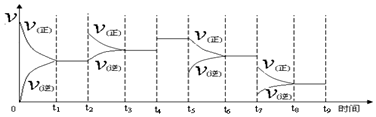
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com