
分析 密度为相同状况下氢气密度的11.25倍,平均摩尔质量为11.25×2=22.5g/mol;
将混合气体通过足量的溴水,溴水增重4.2g,则烯烃的质量为4.2g,气体的总物质的量为$\frac{9g}{22.5g/mol}$=0.4mol,由平均摩尔质量可知一定含甲烷,结合质量、物质的量计算,以此来解答.
解答 解:(1)由气态烷烃和气态单烯烃组成的混合气体是同种状况下H2密度的11.25倍,
则:M(混合)=11.25×2g/mol=22.5g/mol,
故答案为:22.5;
烯烃的摩尔质量最小为28g/mol,则烷烃的摩尔质量应小于22.4g/mol,所以混合气体中一定含有甲烷,
气体的总物质的量为$\frac{9g}{22.5g/mol}$=0.4mol,
混合气体通过足量的溴水,溴水增重4.2g为烯烃的质量,所以甲烷的质量为:9g-4.2g=4.8g
甲烷的物质的量为:n(CH4)=$\frac{4.8g}{16g/mol}$=0.3mol,
所以烯烃的物质的量为0.4mol-0.3mol=0.1mol,所烯烃的摩尔质量为$\frac{4.2g}{0.1mol}$=42g/mol,
设烯烃的化学式为CnH2n,
则:12n+2n=42,
解得:n=3,即烯烃为丙烯,
该混合物为甲烷与丙烯的混合气体,
(2)由上述分析可知,必有甲烷,故答案为:A;
(3)气态烯烃的物质的量为0.1mol,故答案为:0.1.
点评 本题考查有机物分子式计算的确定,为高频考点,把握平均摩尔质量、判断混合物一定含甲烷为解答的关键,侧重分析与计算能力的考查,注意平均摩尔质量的应用,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(l)△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水不能使干燥的有色布条褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: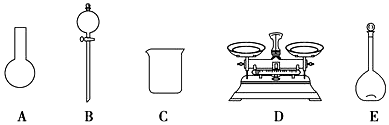
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

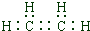 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com