
A.Cl2+2Br-====2Cl-+Br2
B.Cl2+2Fe2+====2Cl-+2Fe3+
C.2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
D.4Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
C
解析:由反应3Br2+6FeCl2====4FeCl3+2FeBr3,可知Fe2+的还原性大于Br-,当Cl2通入到FeBr2溶液中时Cl2首先氧化Fe2+;当溶液中Fe2+全部被氧化成Fe3+后,Cl2才氧化Br-,这样就有两个恰好完全反应的点:一是Fe2+全部被氧化为Fe3+;二是Br-全部被氧化为Br2。①当n(Cl2)∶n(FeBr2)=1∶2时,Fe2+恰好被全部氧化:3Cl2+6FeBr2====2FeCl3+4FeBr3,Cl2+2Fe2+====2Cl-+2Fe3+,②当n(Cl2)∶n(FeBr2)=3∶2时,Br-全部被氧化成Br2;3Cl2+2FeBr2====2FeCl3+2Br2,3Cl2+2Fe2++4Br-====2Fe3++6Cl-+2Br2。③当1∶2<n(Cl2)∶n(FeBr2)<3∶2时,Fe2+全部被氧化成Fe3+,Br-被部分氧化成Br2,另一部分留在溶液中。
![]()
n(FeBr2)=0.01 L×0.5 mol·L-1=0.005 mol,
![]()
故溶液中Br-部分被氧化成Br2,反应方程式为:6Cl2+6FeBr2====4FeCl3+2FeBr3+3Br2。
离子方程式为:2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
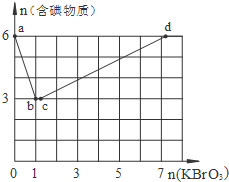 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.Cl2+2Br-====2Cl-+Br2
B.Cl2+2Fe2+====2Cl-+2Fe3+
C.2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
D.2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:013
|
已知3Br2+6FeCl2 | |
| [ ] | |
A. |
Cl2+2Br- |
B. |
Cl2+2Fe2+ |
C. |
2Fe2++2Br-+2Cl2 |
D. |
2Fe2++4Br-+3Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com