
【题目】假设x是第IIB族中元素的原子序数,那么原子序数为x+1的元素在
A. IB族 B. IIIA族 C. IIIB族 D. IA族
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下各组溶液中Cl-的物质的量浓度与300 mL 1 mol/L NaCl溶液中Cl-的物质的量浓度相同的是
A. 100 mL 1 mol/L AlCl3溶液 B. 200 mL 1 mol/L MgCl2溶液
C. 100 mL 0.5 mol/L CaCl2溶液 D. 100 mL 2 mol/L KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭可以转化为清洁能源和化工原料.
(1)用煤可以制得水煤气.工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+![]() O2(g)═CO(g)△H1=-110.5kJmol-1
O2(g)═CO(g)△H1=-110.5kJmol-1
2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJmol-1
试求水煤气法制氢气的反应的反应热△H3.
C(s)+H2O(g)═CO(g)+H2(g)△H3= ______ kJmol-1
(2)若H-H、O=O和O-H键的键能分别是436kJmol-1、496kJmol-1和mkJmol-1,结合上述热化学方程式的相关数据计算,m= ______ .
(3)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

则此反应为 ______ (填“吸热”或“放热”)反应,反应的热化学方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑤NaOH固体⑥SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩饱和FeCl3溶液 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程为___________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是
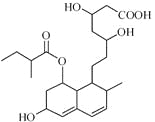
A. 能与FeCl3溶液发生显色反应
B. 能使酸性KMnO4溶液褪色
C. 能发生加成、取代、消去反应
D. 1mol该物质在溶液中最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )

A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化密度为1.19g/mL、质量分数为36.5%的盐酸。反应的化学方程式如下:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题:
(1)求该盐酸的物质的量浓度。
(2)耗15.8 g KMnO4时,有多少摩尔HCl被氧化?
(3)耗15.8 g KMnO4时,产生的Cl2在标准状况下的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:

己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com