

分析 (1)A.铁、铜形成原电池时,Fe作负极被腐蚀;
B.与负极相连,作阴极,被保护;
C.Fe作阴极,阴极上氢离子得电子;
(2)通入NaClO溶液的一极为正极,另一极为负极,则Y为Mg电极,作负极,正极上次氯酸根离子得电子生成氯离子;
(3)①Cu失电子生成Cu2O,Cu为阳极,则石墨为阴极;
②根据Cu2O与电子之间的关系计算;
③阴极上水电离的氢离子得电子生成氢气.
解答 解:(1)A.铁、铜形成原电池时,Fe作负极被腐蚀,所以R为Cu时,不能保护铁闸,故A错误;
B.与负极相连,作阴极,被保护,所以乙图中铁闸门应与电源的负极连接,故B正确;
C.Fe作阴极,阴极上氢离子得电子,则乙图中铁闸门上发生:2H++2e-=H2↑,故C错误;
故答案为:B;
(2)Mg-NaClO燃料电池中,通入NaClO溶液的一极为正极,另一极为负极,则Y为Mg电极,作负极,正极上次氯酸根离子得电子生成氯离子,则正极的电极方程式为:ClO-+H2O+2e-=Cl-+2OH-;
故答案为:Y;ClO-+H2O+2e-=Cl-+2OH-;
(3)①Cu失电子生成Cu2O,Cu为阳极,则石墨为阴极,所以石墨应该与电源的负极相连;
故答案为:负极;
②2molCu生成1molCu2O转移2mol电子,所以当有0.1molCu2O生成时,转移电子的物质的量为0.2mol;
故答案为:0.2mol;
③阴极上水电离的氢离子得电子生成氢气,其电极方程式为:2H2O+2e-=H2↑+2OH-;
故答案为:2H2O+2e-=H2↑+2OH-.
点评 本题考查了原电池原理和电解池原理的分析应用,把握原电池原理和电解池原理以及电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
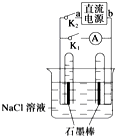
| A. | 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极 | |
| B. | 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧 杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则 a为负极,b为正极 | |
| C. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒 | |
| D. | 若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则左侧石墨棒上发生的电极反应为H2-2e-+2OH-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核能的利用可能会造成放射性污染,应该立即关闭所有核电站 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 泡沫灭火器中使用了盐类水解的原理 | |
| D. | 宁德新能源公司生产的锂离子电池可以将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4的电子式: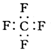 | B. | 对甲基苯酚的结构简式: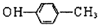 | ||
| C. | 甲酸甲酯的实验式:CH2O | D. | ${\;}_{8}^{16}$O2-离子的结构示意图: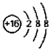 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、CO32-、Cl- | B. | Na+、Ba2+、HCO3-、OH- | ||
| C. | Mg2+、H+、Cl-、SO42- | D. | K+、SO42-、Cu2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com