
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 盐酸可以和过氧化钠反应产生氧气,和碳酸钠、碳酸氢钠反应可以释放出二氧化碳,二氧化碳可以和氢氧化钠反应,氧气不反应,碳酸氢钠受热分解会生成二氧化碳气体,氧化钠和氧气反应是固体质量增加的反应.
解答 解:向混合物中加入足量的盐酸,有气体放出,与盐酸反应产生气体的物质可能为Na2O2(生成O2)、Na2CO3或NaHCO3(生成CO2),X通过NaOH溶液后体积缩小(而不是气体全部消失),说明X由O2和CO2组成,原粉末中Na2O2一定存在,Na2CO3和NaHCO3至少有一种一定存在.将原混合粉末加热,有气体放出,说明混合物中一定有NaHCO3,但NaHCO3受热分解会使粉末质量减小,而实际剩余固体的质量却增加了,原因只能是发生了反应:2Na2O+O2=2Na2O2; 综上分析,混合物中一定有Na2O、Na2O2、NaHCO3,无法确定混合物中是否有Na2CO3和NaCl,即正确的是①④.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及反应现象,本题注意氧化钠和过氧化钠的性质,难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉没有甜味,因此不属于糖类 | B. | 肥皂水可以区别硬水和软水 | ||
| C. | 生铁和钢都是铁的合金 | D. | 钢筋混凝土是复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子由1个u夸克和及1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| B. | 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| C. | 质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 | |
| D. | 质子由2个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
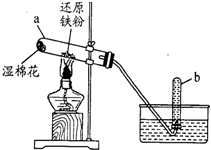
| A. | 甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 | |
| B. | 乙同学认为试管a中生成的黑色固体可能为四氧化三铁 | |
| C. | 丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 | |
| D. | 丁同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
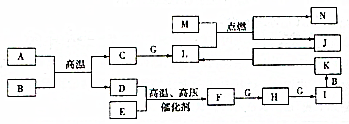 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com